今年美國臨床腫瘤學會(American Society of Clinical Oncology,ASCO)年會,最熱門的議題當屬:癌症免疫治療 (Immuno-therapy) 或免疫腫瘤學 (Immuno-oncology),有相當多的臨床試驗數據和新藥研究進展都在 ASCO 大會競相發表,不僅是今年的當紅炸子雞,更是將來臨床醫療的發展主流。
二十年磨一劍 癌症免疫治療趨勢崛起
論癌症免疫治療的起源,可從 90 年代開始談起,1992 年日本免疫學者 本庶佑 (Tasuku Honjo) 博士發現免疫細胞上的 PD-1 分子,其研究團隊隨後證明 PD-1 是 T 細胞上的抑制受體,在腫瘤逃避機制上扮演著關鍵角色。2001 年首度有研究指出,透過抑制劑阻斷 PD-1 和 PD-L1 結合的分子機轉,將能避免腫瘤細胞逃脫免疫T細胞的攻擊,達到治療癌症的效果。在 2008 年開始第一個臨床試驗後,直到 2014 年 PD-1 抑制劑 Opdivo(nivolumab)與 Keytruda(pembrolizumab)分別獲得美國食品藥物管理局 (FDA) 批准上市,全球開始掀起一股癌症免疫療法的新浪潮。本庶佑 (Tasuku Honjo) 博士也在 2014 年獲得唐獎的生物醫藥獎 (Tang Prize for Bio-pharmaceutucal Science) 的殊榮肯定。
近年來,免疫療法的臨床進展極為快速,截至目前就已經有 6 種免疫檢查點抑制劑 (Immune Checkpoint Inhibitor) 藥物,包括:PD-L1 抑制劑 (Atezolizumab、Avelumab、Durvalumab)、PD-1 抑制劑(Pembrolizumab、Nivolumab) 和 CTLA-4 抑制劑 (Ipilimumab) 等,獲得美國 FDA 批准上市,核可的適應症多達十多種癌症,可望為癌症的患者帶來新的契機。

PD-L1 和腫瘤基因突變負荷量 (TMB) 可能是評估免疫治療的重要生物標記
Charles G. Drake 博士表示,近年來的臨床腫瘤領域病理檢驗也開始將 PD-L1 在腫瘤的免疫組織染色 (IHC) 表現量視為重要的生物標記之一,目前已證實在頭頸癌當中具有高度 PD-L1 表現的患者存活率明顯低於 PD-L1 低度表現或未表現的患者,可將 PD-L1 的表現當作評估腫瘤預後的負面參考指標(Negative Prognostic Marker)。同時也有臨床研究指出,若腫瘤組織具有高度表現的 PD-L1,癌症患者對於 PD-L1 抑制劑和 PD-1 抑制劑藥物治療的反應效果較佳,因此 PD-L1 也被視為評估是否採用免疫療法的預測性生物標記 (Predictive Biomarker),但在不同的癌症種類上的預測效果並不一致,仍需要更多臨床試驗數據來佐證。

Charles G. Drake 博士
來自史隆·凱特琳紀念癌症研究中心 (Memorial Sloan-Ketterlin Cancer Center) 的 Timothy An-thy Chen 醫師講述,在評估免疫治療的需要性時,腫瘤基因突變負荷量 (Tumor Mutation Burden, TMB) 可以視為一項重要的參考指標。根據一份第三期臨床試驗的數據顯示,將非小細胞肺癌患者分為高腫瘤基因突變負荷量 (High TMB) 和低腫瘤基因突變負荷量 (Low TMB) 兩組分別進行免疫治療與化學治療,高腫瘤基因突變負荷量 (High TMB) 組進行免疫治療的無進展生存期(Progression-Free Survival,PFS)明顯高於化學治療,而低腫瘤基因突變負荷量 (Low TMB) 組的結果則完全相反,化學治療的效果明顯優免疫治療。因此,美國 FDA 也已正式將 TMB 或腫瘤微衛星不穩定 (Microsatellite Instability High, MSI – H)列為重要的免疫治療臨床試驗的重要參考指標。

Timothy An-thy Chen 醫師
綜觀來看,容易因接觸外在致癌物質導致高度基因突變的癌症種類,例如:吸菸可能導致的肺癌、頭頸癌(口腔、食道、咽喉)、膀胱癌 和照射紫外光 (UV light) 可能導致的黑色素瘤 (Melanoma),接受免疫療法的治療效果普遍較佳。反之,若低度基因突變的癌症種類,則是選擇標靶藥物治療 (Target Therapy) 或化學治療 (Chemo Therapy) 較為合適。來自耶魯大學醫學院 (Yale School of Medicine) 的 Kurt A. Schalper 博士指出,由於近年來液態生物檢體 (Liquid Biopsy) 和次世代定序 (NGS) 技術崛起,從患者血液當中的即可分析游離腫瘤 DNA (ctDNA),也能成為評估腫瘤基因突變負荷量的方法之一。

Kurt A. Schalper 博士
新的免疫檢查抑制劑成為藥物開發熱門標的
免疫檢查點抑制劑除了以常見的 PD-1、PD-L1、CTLA-4 為標的外,Timothy A. Yap 醫師代表研究團隊在 ASCO 大會上發表,近期有新的標的 ICOS (Inducible CO stimulator of T cell) 被發現也具有成為免疫治療標的潛力,並且有代表性的藥物 JTX-2011 已經進入臨床試驗階段,將在第二期針對非小細胞肺癌、遺傳性非息肉大腸直腸癌 (Hereditary Nonpolyposis Colorectal Cancer, HNPCC)、三陰性乳癌 (TNBC)、黑色素瘤 (Melanoma)、胃癌 (Gastric cancer) 等五項適應症進行臨床試驗,初次給予治療的安全劑量約為 0.3mg/kg,目前已經有相當不錯的數據結果。

Timothy A. Yap 醫師
Rachel E. Shanborn 團隊則發表,Anti-CD27 抗體 (Varlilumab) 與 PD-1 抑制劑 (Nivolumab) 合併治療的研究,在大腸直腸癌和卵巢癌已順利進行第一期和第二期臨床試驗,數據顯示使用 3mg/kg 的 Varlilumab 為最適劑量,能有效輔助增強 PD-1 抑制劑 (Nivolumab) 的治療效果。

Rachel E. Shanborn 團隊
史丹佛大學醫學院的 Branimir I. Sikic 博士發表 5F9 (Anti-CD47) 的研究結果,其團隊發現 5F9 (Anti-CD47) 是鎖定腫瘤細胞表面所表現的 CD47 為阻斷目標,CD47 是腫瘤細胞為了躲過巨噬細胞(Macrophage)攻擊,所釋放的「不要吃我信號 (Don`t eat me signal)」,5F9(Anti-CD47) 可以阻斷腫瘤的 CD47 表現抗原,讓巨噬細胞可以正常辨認吞噬腫瘤細胞,相當有機會藉此機轉進行免疫治療。
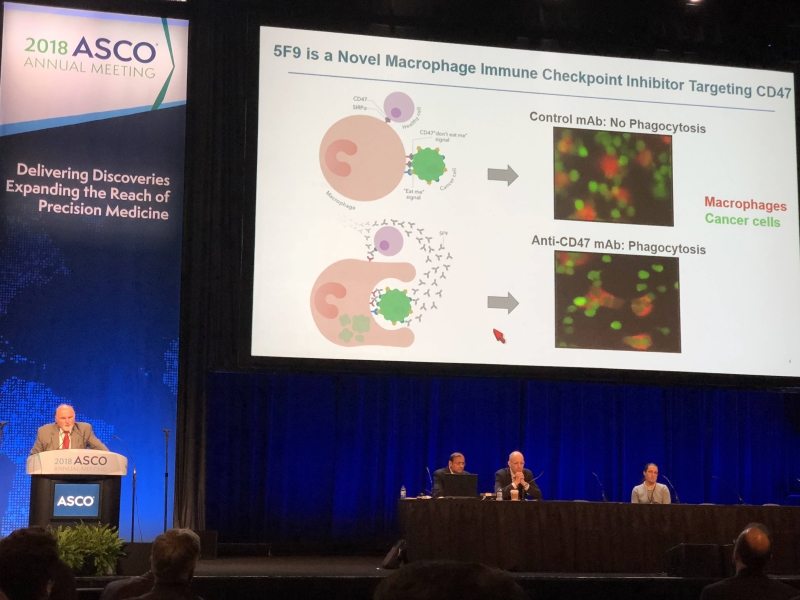
史丹佛大學醫學院的 Branimir I. Sikic 博士
德州大學安德森癌症中心 (MD Anderson Cancer center) 的 Patrick Hwu 醫師在演講中總結,在當今與未來的臨床癌症治療要增進患者免疫反應可能有二大方向:(一) T 細胞免疫反應:免疫節點抑制劑(ex:PD-1、CTL4)、移植培養馴化後的 T 細胞 (ex:CAR-T) 或 增強免疫細胞激素 (Cytokines) 的正向訊號 (ex: NKTR-214 是 CD-122 的激活劑) 和細胞受器激活劑 (ex:JTX-2011 就是 ICOS 的激活劑)等。(二) 腫瘤微環境 (Tumor Microenvironment) 包括:抑制性蛋白質 (ex:TGF-β 的輔助) 或其他免疫細胞 (Treg、巨噬細胞)。

癌症免疫治療小插曲 不良反應風險仍瑕不掩瑜
錫安山醫學中心 (Cedars Sinai medical center) 的 Steven Hsiao 博士提到,免疫治療的效果是受到肯定的,但也有可能造成一些意外發生,目前已知免疫治療可能會產生心臟毒性 (Cardiac Toxicity) 的不良反應風險,但目前美國 FDA 和歐洲藥物管理局都尚未對此提出警語。為了瞭解癌症免疫治療後發生心臟毒性不良反應的風險有多高,他的研究團隊著手進行一個涵蓋 21,664 名患者的臨床試驗。其研究結果顯示,單獨使用 PD-1/PD-L1 阻斷劑進行免疫治療產生心臟毒性的風險極低 (僅 0.02%),但若將 PD-1/PD-L1 和 CTLA-4 阻斷劑合併使用進行免疫治療產生心臟毒性的風險將增加 7.42 倍 (0.13%),進行合併治療 (Combined Therapy) 時應加以留意。
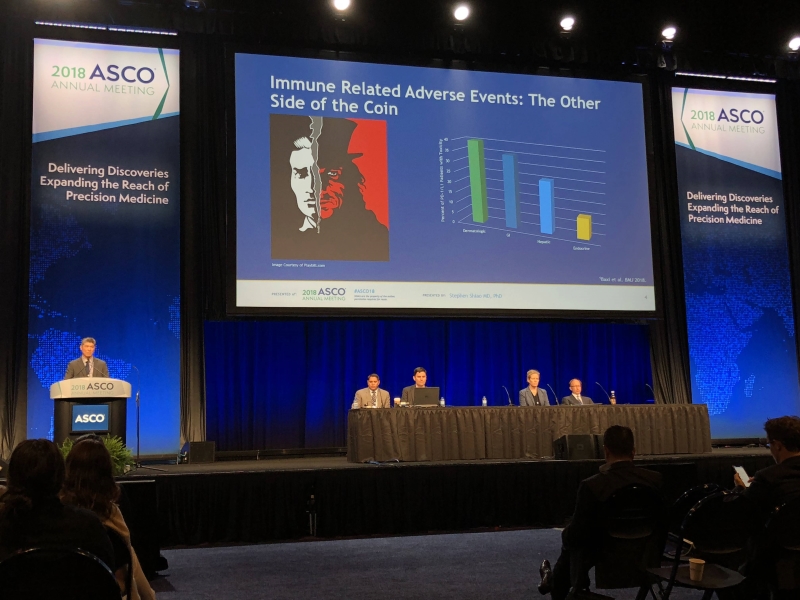
Steven Hsiao 博士
另外,他還提到近期有研究指出,腸道微生物的多樣性會調控免疫系統進而影響到癌症免疫治療和化學治療的效果,他們蒐集了 38 名進行 PD-1 阻斷劑治療的患者糞便進行 16s RNA 序列分析,發現腸道菌多樣性高的組別的存活率 (PFS) 明顯高於多樣性低的組別。但是,目前有 31% 的臨床患者會使用抗生素 (Antibiotics),這會造成腸道菌的多樣性和數量驟降,進而可能影響到癌症免疫治療之成效,特別提醒在抗生素的使用上需要謹慎留意。
CAR-T 的下一步:挑戰實質固態瘤之治療
賓州大學的 Carl H. June 醫師表示,癌症免疫療法除了免疫檢查點抑制劑外,嵌合抗原受體 T 细胞 (Chimeric Antigen Receptor T Cells, CAR-T) 也是一種非常熱門且具潛力的治療方法,是運用合成生物學 (Synthetic Biology) 或基因編輯 (Gene Editing) 的技術將癌細胞的 MHC 表面抗原 (身分證),利用改造的病毒外殼,把辨識腫瘤抗體片段送進 T 細胞內進行表現,再將這些馴化過的 CAR-T 細胞培養擴增後,回輸到患者體內進行細胞治療。CAR-T 細胞的來源包括:患者自己的 T 細胞、臍帶血、健康的捐贈者、誘導性多功能幹細胞 (Induced pluripotent stem cell, iPSC)等。他分享 2010 年,研究團隊首次嘗試為一位罹患急性淋巴性白血病(Acute Lymphoblastic Leukemia,ALL)的小女孩進行治療,竟然完全治癒並健康存活至今,使得 CAR-T 的臨床研究獲得極大的關注,後續臨床試驗也非常順利,並且在 2017 年成為全球第一個獲得 FDA 許可上市 CAR-T 藥物 (Kyrmiah)。

Carl H. June 醫師
接下來值得探討的問題是,CAR-T 是否能夠在實質固態瘤 (Solid Tumors) 也能達到治療效果? 因為血液腫瘤療時,CAR-T 細胞能夠在血液循環當中直接殺死癌細胞的效率極高,但若要將 CAR-T 細胞隨著血液循環送到固態腫瘤,則還需要突破層層關卡,才可能達到治療效果。賓州大學研究團隊開始嘗試將前列腺癌細胞模特有抗原 (Prostate-Specific Membrane Antigen ,PSMA) 和 TGF-β 的基因序列融合到 CAR-T 當中進行「武裝」,在前列腺癌小鼠的動物實驗已經顯著看到治療成效,目前正在進行第一期的人體臨床試驗 (#NCT03089203),結果相當值得持續關注。
文 / John Hung
延伸閱讀:2018年ASCO現場報導(一): 推動人人受益的精準醫療<更多發燒議題 敬請期待 ASCO 系列報導>
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com





