近年來醫藥發展迅速,基因編輯、細胞培養和保存等技術逐漸成熟,國際上基因治療製劑陸續核准上市,對於傳統化學或生物製劑無法治癒之疾病,基因治療應用於臨床,亦提供醫師及病人更加新穎且多元治療選項。本篇將彙整 2022 年核准的基因治療,讓大家了解這一年所核准的藥物以及治療領域。
第一款核准用於治療高度風險非肌肉侵犯性膀胱癌
膀胱癌佔我國男性十大癌症第八位,其常見的症狀為無痛性血尿。為了降低復發風險,非肌肉侵犯性膀胱癌治療大多給予數次的膀胱內雞尾酒化療以及卡介苗(BCG),那些對於 BCG 有反應者,可降低復發且減少不良反應發生比例;但對於 BCG 無反應者,則幾乎無有效治療選項。
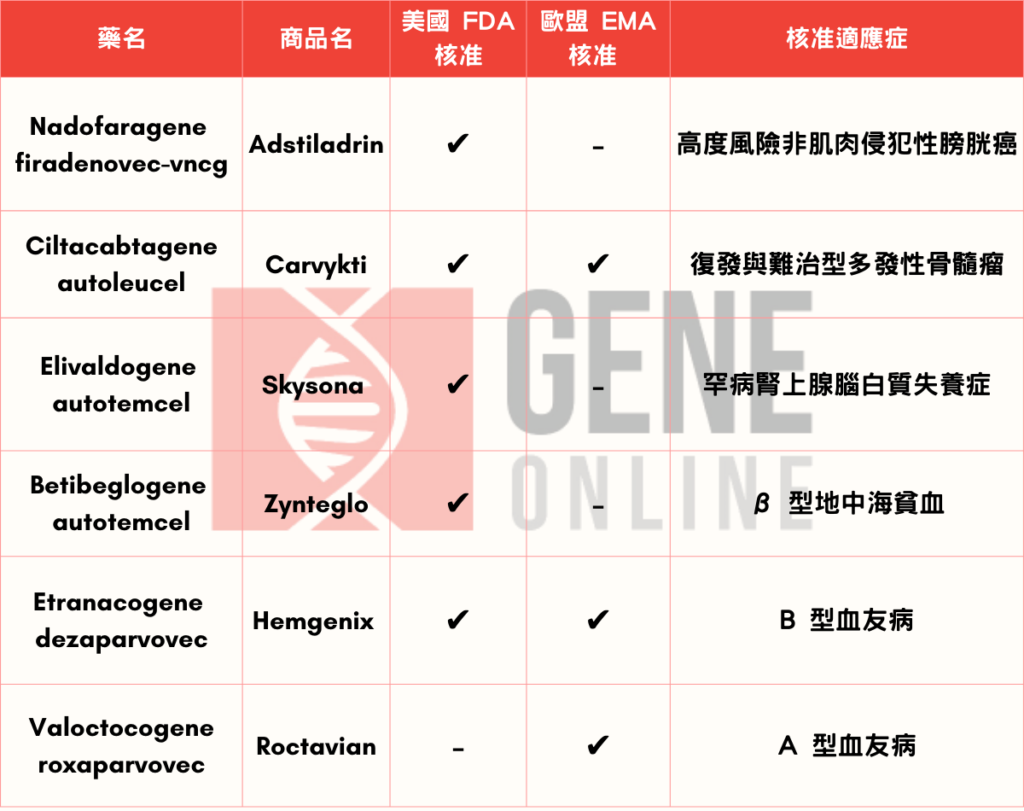
Ferring 藥廠旗下 Adstiladrin (nadofaragene firadenovec-vncg) 於 2022 年 12 月獲得美國 FDA 核准,其原因主要來自一項多中心臨床試驗結果,試驗中共納入157 位高度風險 BCG 無反應非肌肉侵犯性膀胱癌病人,其中包含 97 名罹患 BCG 無反應原位癌(carcinoma in situ, CIS)伴隨或不伴隨乳頭狀腫瘤(papillary tumor)共同進行評估。受試者每三個月通過導尿管進入膀胱接受一次 Adstiladrin ,治療將持續至 12 個月或直到對治療產生無法耐受的毒性,亦或是復發或疾病進展至高級別 NMIBC 等。
試驗結果顯示,接受 Adstiladrin 後共 51% 的受試者達到完全反應 (complete response, CR),這代表無論是膀胱鏡檢查、活檢組織和尿液中所見的所有癌症跡象均消失。中位數反應持續時間為 9.7 個月。約 46% 的病人可維持長達一年的完全反應狀態。 Adstiladrin 的常見不良反應為膀胱分泌物、疲勞、膀胱痙攣、尿急、血尿、發冷、發燒和排尿疼痛。 此藥不建議用於具免疫抑制或免疫缺陷的病人。
復發與難治型多發性骨髓瘤多一項 CAR-T 治療選項
多發性骨髓瘤是一種惡性血液腫瘤,病因是病人骨髓的漿細胞(plasma cell)不正常增生所致。多數病人接受初始治療後容易復發,並在使用藥物治療如免疫調節劑、單株抗體後面臨預後不良的情形。
Carvykti(ciltacabtagene autoleucel) 是由嬌生集團(Johnson & Johnson)旗下楊森(Janssen)藥廠與中國南京傳奇(Nanjing Legend Biotech)合作開發的療法。此藥已於去年(2022 年)二、三月分別獲得美國 FDA 以及歐盟人體藥品委員會 (CHMP) 上市許可,一舉開拓歐、美兩地治療市場。所核准適應症為復發與難治型多發性骨髓瘤(relapse/refractory multiple myeloma, R/R MM)。
Carvykti 獲得核准是基於 CARTITUDE-1 第1b/2 期臨床試驗,該試驗在 ASCO 2022 上所報導的數據顯示 97 名受試者的整體反應率(overall response rate, ORR)為 98% (95% 信賴區間 92.7 至 99.7),其中 83% (95% 信賴區間 73.4 至 89.4) 受試者的達到完全緩解率(complete response, CR)。中位數無惡化存活期(progression free survival, PFS)以及整體存活期(overall survival, OS)皆未達到。追蹤 28 個月顯示,其惡化存活率為 55% (95%信賴區間, 44.0 至 64.6) 以及整體存活率為 70% (95%信賴區間, 60.1 至 78.6)。試驗中並未通報新的不良事件。最常見的不良事件為嗜中性白血球低下症(96%) 、貧血(81%)、血小板減少症(79%)、白血球低下(62%)以及淋巴球減少(54%)。
天價昂貴藥物有它!bluebird 旗下 Skysona 成為首支兒童腦部罕見疾病基因治療藥
CALD 是一種罕見的神經退化性疾病,是罕病腎上腺腦白質失養症(adrenoleukodystrophy, ALD)最常見的一種疾病形式,每 21,000 名新生兒男性中約有 1 名 CALD 病例。疾病成因是由於 ABCD1 基因異常,導致 ALDP 蛋白(adrenoleukodystrophy protein)缺乏所致。
美國 FDA 的核准是基於 Skysona(elivaldogene autotemcel)的第 2/3 期試驗 ALD-102(n=32)與 3 期試驗 ALD-104(n=35)結果。兩項開放標籤、單臂試驗招募的 CALD 病人都有以下臨床特徵,包含體內超長鏈脂肪酸 (VLCFA) 濃度數值高、神經功能評分(neurologic function score,NFS) ≤ 1。
在主要試驗 ALD-102 中,32 名接受治療的病人中有 29 名在兩年內沒有死亡或出現嚴重不良事件反應,追蹤 24 個月結果 90% 受試者仍存活,達到主要療效指標。進一步的追蹤觀察也證實其臨床效益可維持 5 年。
不過先前 Skysona 也曾引發安全疑慮,2021 年 8 月相關試驗曾傳出病人治療 1 年後,罹患骨髓造血病變:骨髓增生不良症候群(myelodysplastic syndromes),這種症狀可能演變為白血病,此案例使得 FDA 中止該試驗進行。隨著調查結果出爐,此次 2022 年核准也伴隨 FDA 宣布取消臨床試驗中止的決定,bluebird 得以繼續進行 Skysona 的長期追蹤試驗。
此藥單次要價 300 萬美元,為 2022 年核准天價藥之一。由於藥價高昂,使 bluebird 在歐洲市場重挫,已於 2021 年底將原本唯一已拿到核准的 Skysona 撤出歐洲市場。
2022 核准三大天價藥之一,Zynteglo 放棄歐洲市場,取得美國 FDA 核准第一款治療 β 型地中海貧血
β 型地中海貧血是一種罕見遺傳性疾病,美國大約有 1,300-1,500 人患有依賴終身輸血的 β 型地中海貧血,過去十年,這類病患的中位數死亡年齡僅 37 歲。而在台灣 β 型地中海貧血發病率約為 2%。由於 β-globin 基因異常導致血紅素(hemoglobin)生成濃度過低,嚴重病患需要終身仰賴定期輸血,約每 2-5 週進行一次。但是輸血只能暫時性緩解貧血症狀,且長期輸血有引發鐵質沈積的副作用風險,過高的鐵蛋白濃度可能引發心臟衰竭、肝硬化等發病率,也增加死亡風險。
與 Skysona 同屬 bluebird 旗下的 Zynteglo( betibeglogene autotemcel)獲得美國 FDA 核准是基於兩項第 3 期臨床數據結果,共納入 41 名年齡 4 -34 歲之間的 β 型地中海貧血病人,試驗最長追蹤時間為 4 年。根據 ASH 2022 更新長期觀察結果顯示,90.2% 病人(37/41) 達到主要療效指標為至少 12 個月內不再需要輸血(transfusion independence),總血紅素濃度至少 9 g/dL。
根據 LTF-303 長期追蹤研究,預期以15 年時間搜集病人治療後證實的改善情況,接受 beti-cel 治療後病人在長達三年後觀察到,治療能顯著改善生活品質。其中100% 的病人皆通報接受 beti-cel 治療整體是獲益的,有高達 93% 的病人可以重回工作崗位或接受新工作,81% 通報三年後身體活動有所改善,同時在治療後,病人缺課的情形亦大幅降低。
雖然基因治療可降低輸血頻率,但基因治療並非無風險,FDA 確實有注意到 Zynteglo 可能的癌症風險,並建議在接受基因治療後,對病人進行 15 年的觀察;不過 FDA 專家小組也認為療程所帶來的益處超過任何潛在危害。
據了解,此藥單劑藥價為 280 萬美元,成為 2022 年美國 FDA 核准天價排名第三的藥物。此藥亦因 bluebird 公司決定撤出歐洲市場。
Hemgenix 為年度最貴天價藥也是 EMA 第一款核准治療 B 型血友病藥品
B 型血友病屬 X 染色體性聯之隱性遺傳疾病,其致病原因為第九凝血因子基因異常。根據統計,B 型血友病為 30000 名男性有一位。在常見的基因缺陷上,B 型血友病大型基因缺陷只占 < 10%、而小型基因缺陷(missense mutation) 卻佔 58%。其中嚴重型約佔全部 B 型血友病病人中的 30%,且病人中抗體發生比例約佔 3-5%。
目前獲准用於治療 B 型血友病的藥物旨在預防出血事件或治療即使正接受常規治療仍可能在手術或緊急情況下發生的出血事件。 如果病人需要終身常規治療,即靜脈注射第九因子替代產品,以維持足夠的第九因子需求。 因此,現階段在尋找新的治療以終身解決 B 型血友病病人的方案上仍存在未滿足的醫療需求。
CSL 旗下 Hemgenix(etranacogene dezaparvovec)為一次性的治療產品,其以腺相關病毒(adeno-associated virus vector, AAV)為載體,攜帶能生成第 9 凝血因子的基因,以替補病人缺陷的基因功能。此藥公布,單次要價為 350 萬美元,為年度最貴藥品。
Hemgenix 於 2022 年 11 月獲得美國核准上市,緊接著於同年 12 月獲得歐盟 EMA 有條件核准上市( conditional marketing authorisation )許可。核准原因主要基於兩項前瞻性、開放標籤、單劑量、單臂試驗結果,共納入 57 名患有中重度或重度 B 型血友病的成年男性病人。 在第一項研究中,三名病人在注射 Hemgenix 後長達三年的時間裡一直保持著正向的治療效果。 而在第二項研究中,則有 52 名病人在注射 Hemgenix 後長達兩年的時間裡仍保持正向的治療效果。 目前尚不清楚這一次性治療後的好處能持續多久。
根據療效評估結果顯示,相較於標準治療,Hemgenix 能顯著降低出血頻率(年出血率從每年 4.19 次減少到 1.51 次),第九因子達到臨床需要的指數,並以最大限度降低對預防性第九因子替代療法的需求(接受 Hemgenix 治療的受試者中約 96% 停止使用常規預防措施)。
Hemgenix 所通報的大多為輕微的不良事件。 Hemgenix 曾通報過報導肝毒性(或肝損傷),這是因基於 AAV 的基因療法誘導的免疫反應所引起的常見不良事件,其特徵是轉氨酶(transaminase)的指數升高,這種情況可以用類固醇治療。 此外,應監測病人在接受治療輸液時的相關反應。 其他常見的不良事件包括頭痛和類流感症狀。
BioMarin Pharmaceutical 在歐洲拿下一城!Roctavian 獲得歐洲 EMA 核准治療 A 型血友病
血友病(Hemophilia)病人血液「凝血因子」(coagulation factor)不足,會出現莫名瘀青、流鼻血、關節出血,甚至顱內出血致命,病情嚴重者需每週施打 2~3 次凝血因子,生活品質深受影響非常不便。血液幫助凝固的凝血因子高達13 種,A 型血友病為缺乏第八凝血因子病人,人數最多,占八成以上。輕度血友病病人凝血因子含量仍有正常值 5%~30%,只有手術或較大傷口時才會有失血過多的危險。而重度血友病病人凝血因子僅正常值 1% 以下,較容易出現自發性肌肉或關節出血,可能每個禮拜出血一至二次。
BioMarin Pharmaceutical 旗下 Roctavian (valoctocogene roxaparvovec) 獲得歐洲 EMA 核准主要來自 GENER8-1 第 III 期臨床試驗的兩年數據結果。GENER8-1 III 期為一項單臂試驗,從納入的 112 位 A 型血友病病人中其平均年出血率(annual bleeding rate, ABR) 相較於基線值在治療後第四週下降 84%;而平均年因子 VIII 輸注率相較於基線值,在追蹤第四週則降低 99%;證明其穩定且持久的出血控制。
在 2020 年經美國 FDA 拒絕批准 Roctavian 後,BioMarin Pharmaceutical 重整旗鼓於2022年獲得 EMA 核准。但 BioMarin Pharmaceutical 並沒有放棄向美國 FDA 繼續叩關,已於 2022 年 11月底重新提交 Roctavian 的生物製品許可申請(BLA)。
越來越昂貴的基因治療,病人能否負擔,成最大隱憂?
隨著生物科技發達,基因治療如雨後春筍般出現,盤點 2022 年度基因治療,bluebird 成大贏家,雖然以藥廠的角度,新的基因治療能透過提供修正缺陷基因的版本,大幅幫助罕見基因疾病病人,這些新的療程或許可以治癒,或避免病人在餘生重複接受舊的療程,長期換算下來應能省不少錢。但對於病人與醫療保險業者而言,一次付出龐大金額,顯然無法達成,以近年核准的治療來看,一項新的基因治療,少說從 280 萬美元(約千萬至億萬元台幣)起跳,而且在安全性上基因治療仍存在疑慮。雖說大多數的藥廠都有推出不同支付方案,但這樣的技術是否能讓病人買單,且這樣的治療是否真正符合未滿足醫療需求,仍需時間證明。呼籲主管機關對於新的高價藥品應盡快擬訂更好的議價協議,得出對病人及利於國庫最好且優惠的議價。
延伸閱讀:嚴重複合型免疫缺乏症 (SCID) 治療現曙光!基因治療可望提供解決方案參考資料:
1. https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products/adstiladrin
2. https://www.fda.gov/vaccines-blood-biologics/carvykti
3. https://www.fda.gov/vaccines-blood-biologics/skysona
4. https://www.ema.europa.eu/en/medicines/human/EPAR/skysona
5. https://www.fda.gov/vaccines-blood-biologics/zynteglo
6. https://www.fda.gov/vaccines-blood-biologics/vaccines/hemgenix
7. https://investor.bluebirdbio.com/news-releases/news-release-details/new-data-bluebird-bios-gene-therapies-transfusion-dependent-beta
8. https://www.jnj.com/longer-term-data-from-cartitude-1-study-demonstrate-continued-deep-and-durable-responses-to-carvykti-ciltacabtagene-autoleucel-in-heavily-pretreated-patients-with-relapsed-or-refractory-multiple-myeloma
9. https://abstracts.isth.org/abstract/efficacy-and-safety-of-valoctocogene-roxaparvovec-adeno-associated-virus-gene-transfer-for-severe-hemophilia-a-results-from-the-phase-3-gener8-1-trial/
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com