近年来医药发展迅速,基因编辑、细胞培养和保存等技术逐渐成熟,国际上基因治疗制剂陆续核准上市,对于传统化学或生物制剂无法治愈之疾病,基因治疗应用于临床,亦提供医师及病人更加新颖且多元治疗选项。本篇将汇整 2022 年核准的基因治疗,让大家了解这一年所核准的药物以及治疗领域。
第一款核准用于治疗高度风险非肌肉侵犯性膀胱癌
膀胱癌占我国男性十大癌症第八位,其常见的症状为无痛性血尿。为了降低复发风险,非肌肉侵犯性膀胱癌治疗大多给予数次的膀胱内鸡尾酒化疗以及卡介苗(BCG),那些对于 BCG 有反应者,可降低复发且减少不良反应发生比例;但对于 BCG 无反应者,则几乎无有效治疗选项。
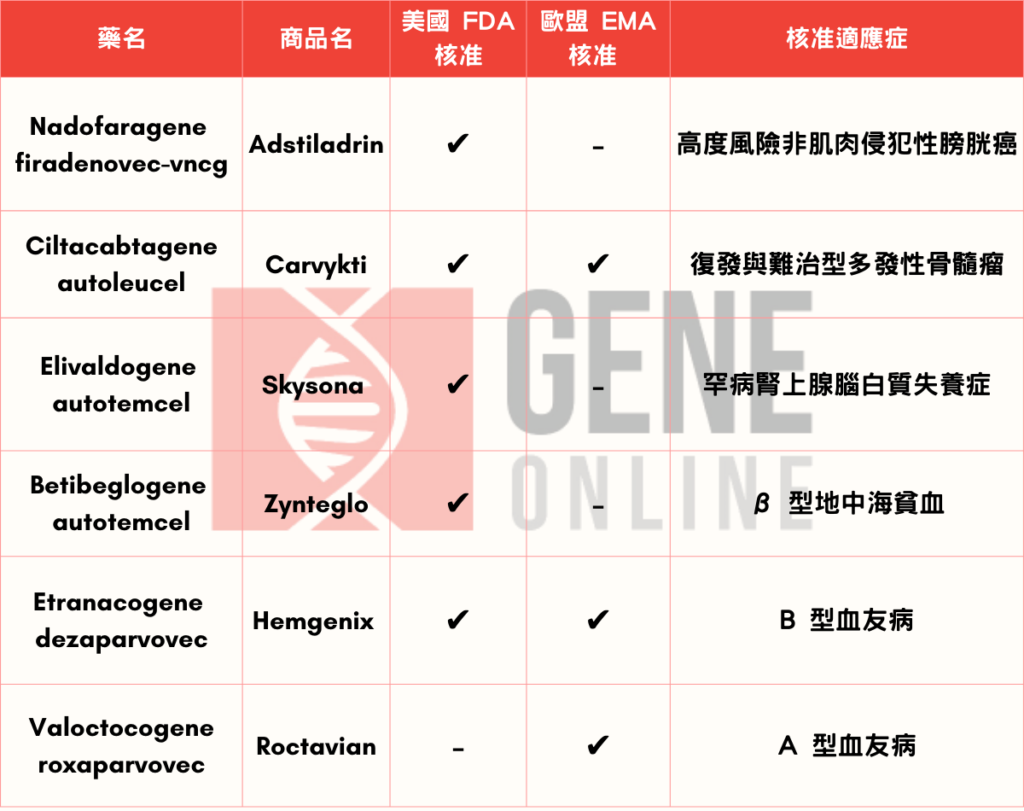
Ferring 药厂旗下 Adstiladrin (nadofaragene firadenovec-vncg) 于 2022 年 12 月获得美国 FDA 核准,其原因主要来自一项多中心临床试验结果,试验中共纳入157 位高度风险 BCG 无反应非肌肉侵犯性膀胱癌病人,其中包含 97 名罹患 BCG 无反应原位癌(carcinoma in situ, CIS)伴随或不伴随乳头状肿瘤(papillary tumor)共同进行评估。受试者每三个月通过导尿管进入膀胱接受一次 Adstiladrin ,治疗将持续至 12 个月或直到对治疗产生无法耐受的毒性,亦或是复发或疾病进展至高级别 NMIBC 等。
试验结果显示,接受 Adstiladrin 后共 51% 的受试者达到完全反应 (complete response, CR),这代表无论是膀胱镜检查、活检组织和尿液中所见的所有癌症迹象均消失。中位数反应持续时间为 9.7 个月。约 46% 的病人可维持长达一年的完全反应状态。 Adstiladrin 的常见不良反应为膀胱分泌物、疲劳、膀胱痉挛、尿急、血尿、发冷、发烧和排尿疼痛。 此药不建议用于具免疫抑制或免疫缺陷的病人。
复发与难治型多发性骨髓瘤多一项 CAR-T 治疗选项
多发性骨髓瘤是一种恶性血液肿瘤,病因是病人骨髓的浆细胞(plasma cell)不正常增生所致。多数病人接受初始治疗后容易复发,并在使用药物治疗如免疫调节剂、单株抗体后面临预后不良的情形。
Carvykti(ciltacabtagene autoleucel) 是由娇生集团(Johnson & Johnson)旗下杨森(Janssen)药厂与中国南京传奇(Nanjing Legend Biotech)合作开发的疗法。此药已于去年(2022 年)二、三月分别获得美国 FDA 以及欧盟人体药品委员会 (CHMP) 上市许可,一举开拓欧、美两地治疗市场。所核准适应症为复发与难治型多发性骨髓瘤(relapse/refractory multiple myeloma, R/R MM)。
Carvykti 获得核准是基于 CARTITUDE-1 第1b/2 期临床试验,该试验在 ASCO 2022 上所报导的数据显示 97 名受试者的整体反应率(overall response rate, ORR)为 98% (95% 信赖区间 92.7 至 99.7),其中 83% (95% 信赖区间 73.4 至 89.4) 受试者的达到完全缓解率(complete response, CR)。中位数无恶化存活期(progression free survival, PFS)以及整体存活期(overall survival, OS)皆未达到。追踪 28 个月显示,其恶化存活率为 55% (95%信赖区间, 44.0 至 64.6) 以及整体存活率为 70% (95%信赖区间, 60.1 至 78.6)。试验中并未通报新的不良事件。最常见的不良事件为嗜中性白血球低下症(96%) 、贫血(81%)、血小板减少症(79%)、白血球低下(62%)以及淋巴球减少(54%)。
天价昂贵药物有它!bluebird 旗下 Skysona 成为首支儿童脑部罕见疾病基因治疗药
CALD 是一种罕见的神经退化性疾病,是罕病肾上腺脑白质失养症(adrenoleukodystrophy, ALD)最常见的一种疾病形式,每 21,000 名新生儿男性中约有 1 名 CALD 病例。疾病成因是由于 ABCD1 基因异常,导致 ALDP 蛋白(adrenoleukodystrophy protein)缺乏所致。
美国 FDA 的核准是基于 Skysona(elivaldogene autotemcel)的第 2/3 期试验 ALD-102(n=32)与 3 期试验 ALD-104(n=35)结果。两项开放标签、单臂试验招募的 CALD 病人都有以下临床特征,包含体内超长链脂肪酸 (VLCFA) 浓度数值高、神经功能评分(neurologic function score,NFS) ≤ 1。
在主要试验 ALD-102 中,32 名接受治疗的病人中有 29 名在两年内没有死亡或出现严重不良事件反应,追踪 24 个月结果 90% 受试者仍存活,达到主要疗效指标。进一步的追踪观察也证实其临床效益可维持 5 年。
不过先前 Skysona 也曾引发安全疑虑,2021 年 8 月相关试验曾传出病人治疗 1 年后,罹患骨髓造血病变:骨髓增生不良症候群(myelodysplastic syndromes),这种症状可能演变为白血病,此案例使得 FDA 中止该试验进行。随着调查结果出炉,此次 2022 年核准也伴随 FDA 宣布取消临床试验中止的决定,bluebird 得以继续进行 Skysona 的长期追踪试验。
此药单次要价 300 万美元,为 2022 年核准天价药之一。由于药价高昂,使 bluebird 在欧洲市场重挫,已于 2021 年底将原本唯一已拿到核准的 Skysona 撤出欧洲市场。
2022 核准三大天价药之一,Zynteglo 放弃欧洲市场,取得美国 FDA 核准第一款治疗 β 型地中海贫血
β 型地中海贫血是一种罕见遗传性疾病,美国大约有 1,300-1,500 人患有依赖终身输血的 β 型地中海贫血,过去十年,这类病患的中位数死亡年龄仅 37 岁。而在台湾 β 型地中海贫血发病率约为 2%。由于 β-globin 基因异常导致血红素(hemoglobin)生成浓度过低,严重病患需要终身仰赖定期输血,约每 2-5 周进行一次。但是输血只能暂时性缓解贫血症状,且长期输血有引发铁质沉积的副作用风险,过高的铁蛋白浓度可能引发心脏衰竭、肝硬化等发病率,也增加死亡风险。
与 Skysona 同属 bluebird 旗下的 Zynteglo( betibeglogene autotemcel)获得美国 FDA 核准是基于两项第 3 期临床数据结果,共纳入 41 名年龄 4 -34 岁之间的 β 型地中海贫血病人,试验最长追踪时间为 4 年。根据 ASH 2022 更新长期观察结果显示,90.2% 病人(37/41) 达到主要疗效指标为至少 12 个月内不再需要输血(transfusion independence),总血红素浓度至少 9 g/dL。
根据 LTF-303 长期追踪研究,预期以15 年时间搜集病人治疗后证实的改善情况,接受 beti-cel 治疗后病人在长达三年后观察到,治疗能显著改善生活品质。其中100% 的病人皆通报接受 beti-cel 治疗整体是获益的,有高达 93% 的病人可以重回工作岗位或接受新工作,81% 通报三年后身体活动有所改善,同时在治疗后,病人缺课的情形亦大幅降低。
虽然基因治疗可降低输血频率,但基因治疗并非无风险,FDA 确实有注意到 Zynteglo 可能的癌症风险,并建议在接受基因治疗后,对病人进行 15 年的观察;不过 FDA 专家小组也认为疗程所带来的益处超过任何潜在危害。
据了解,此药单剂药价为 280 万美元,成为 2022 年美国 FDA 核准天价排名第三的药物。此药亦因 bluebird 公司决定撤出欧洲市场。
Hemgenix 为年度最贵天价药也是 EMA 第一款核准治疗 B 型血友病药品
B 型血友病属 X 染色体性联之隐性遗传疾病,其致病原因为第九凝血因子基因异常。根据统计,B 型血友病为 30000 名男性有一位。在常见的基因缺陷上,B 型血友病大型基因缺陷只占 < 10%、而小型基因缺陷(missense mutation) 却占 58%。其中严重型约占全部 B 型血友病病人中的 30%,且病人中抗体发生比例约占 3-5%。
目前获准用于治疗 B 型血友病的药物旨在预防出血事件或治疗即使正接受常规治疗仍可能在手术或紧急情况下发生的出血事件。 如果病人需要终身常规治疗,即静脉注射第九因子替代产品,以维持足够的第九因子需求。 因此,现阶段在寻找新的治疗以终身解决 B 型血友病病人的方案上仍存在未满足的医疗需求。
CSL 旗下 Hemgenix(etranacogene dezaparvovec)为一次性的治疗产品,其以腺相关病毒(adeno-associated virus vector, AAV)为载体,携带能生成第 9 凝血因子的基因,以替补病人缺陷的基因功能。此药公布,单次要价为 350 万美元,为年度最贵药品。
Hemgenix 于 2022 年 11 月获得美国核准上市,紧接着于同年 12 月获得欧盟 EMA 有条件核准上市( conditional marketing authorisation )许可。核准原因主要基于两项前瞻性、开放标签、单剂量、单臂试验结果,共纳入 57 名患有中重度或重度 B 型血友病的成年男性病人。 在第一项研究中,三名病人在注射 Hemgenix 后长达三年的时间里一直保持着正向的治疗效果。 而在第二项研究中,则有 52 名病人在注射 Hemgenix 后长达两年的时间里仍保持正向的治疗效果。 目前尚不清楚这一次性治疗后的好处能持续多久。
根据疗效评估结果显示,相较于标准治疗,Hemgenix 能显著降低出血频率(年出血率从每年 4.19 次减少到 1.51 次),第九因子达到临床需要的指数,并以最大限度降低对预防性第九因子替代疗法的需求(接受 Hemgenix 治疗的受试者中约 96% 停止使用常规预防措施)。
Hemgenix 所通报的大多为轻微的不良事件。 Hemgenix 曾通报过报导肝毒性(或肝损伤),这是因基于 AAV 的基因疗法诱导的免疫反应所引起的常见不良事件,其特征是转氨酶(transaminase)的指数升高,这种情况可以用类固醇治疗。 此外,应监测病人在接受治疗输液时的相关反应。 其他常见的不良事件包括头痛和类流感症状。
BioMarin Pharmaceutical 在欧洲拿下一城!Roctavian 获得欧洲 EMA 核准治疗 A 型血友病
血友病(Hemophilia)病人血液“凝血因子”(coagulation factor)不足,会出现莫名瘀青、流鼻血、关节出血,甚至颅内出血致命,病情严重者需每周施打 2~3 次凝血因子,生活品质深受影响非常不便。血液帮助凝固的凝血因子高达13 种,A 型血友病为缺乏第八凝血因子病人,人数最多,占八成以上。轻度血友病病人凝血因子含量仍有正常值 5%~30%,只有手术或较大伤口时才会有失血过多的危险。而重度血友病病人凝血因子仅正常值 1% 以下,较容易出现自发性肌肉或关节出血,可能每个礼拜出血一至二次。
BioMarin Pharmaceutical 旗下 Roctavian (valoctocogene roxaparvovec) 获得欧洲 EMA 核准主要来自 GENER8-1 第 III 期临床试验的两年数据结果。GENER8-1 III 期为一项单臂试验,从纳入的 112 位 A 型血友病病人中其平均年出血率(annual bleeding rate, ABR) 相较于基线值在治疗后第四周下降 84%;而平均年因子 VIII 输注率相较于基线值,在追踪第四周则降低 99%;证明其稳定且持久的出血控制。
在 2020 年经美国 FDA 拒绝批准 Roctavian 后,BioMarin Pharmaceutical 重整旗鼓于2022年获得 EMA 核准。但 BioMarin Pharmaceutical 并没有放弃向美国 FDA 继续叩关,已于 2022 年 11月底重新提交 Roctavian 的生物制品许可申请(BLA)。
越来越昂贵的基因治疗,病人能否负担,成最大隐忧?
随着生物科技发达,基因治疗如雨后春笋般出现,盘点 2022 年度基因治疗,bluebird 成大赢家,虽然以药厂的角度,新的基因治疗能透过提供修正缺陷基因的版本,大幅帮助罕见基因疾病病人,这些新的疗程或许可以治愈,或避免病人在余生重复接受旧的疗程,长期换算下来应能省不少钱。但对于病人与医疗保险业者而言,一次付出庞大金额,显然无法达成,以近年核准的治疗来看,一项新的基因治疗,少说从 280 万美元(约千万至亿万元台币)起跳,而且在安全性上基因治疗仍存在疑虑。虽说大多数的药厂都有推出不同支付方案,但这样的技术是否能让病人买单,且这样的治疗是否真正符合未满足医疗需求,仍需时间证明。呼吁主管机关对于新的高价药品应尽快拟订更好的议价协议,得出对病人及利于国库最好且优惠的议价。
延伸阅读:严重复合型免疫缺乏症 (SCID) 治疗现曙光!基因治疗可望提供解决方案参考资料:
1. https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products/adstiladrin
2. https://www.fda.gov/vaccines-blood-biologics/carvykti
3. https://www.fda.gov/vaccines-blood-biologics/skysona
4. https://www.ema.europa.eu/en/medicines/human/EPAR/skysona
5. https://www.fda.gov/vaccines-blood-biologics/zynteglo
6. https://www.fda.gov/vaccines-blood-biologics/vaccines/hemgenix
7. https://investor.bluebirdbio.com/news-releases/news-release-details/new-data-bluebird-bios-gene-therapies-transfusion-dependent-beta
8. https://www.jnj.com/longer-term-data-from-cartitude-1-study-demonstrate-continued-deep-and-durable-responses-to-carvykti-ciltacabtagene-autoleucel-in-heavily-pretreated-patients-with-relapsed-or-refractory-multiple-myeloma
9. https://abstracts.isth.org/abstract/efficacy-and-safety-of-valoctocogene-roxaparvovec-adeno-associated-virus-gene-transfer-for-severe-hemophilia-a-results-from-the-phase-3-gener8-1-trial/
©www.geneonline.news. All rights reserved. 基因线上版权所有 未经授权不得转载。合作请联系:service@geneonlineasia.com