Eisai Co., Ltd. 于 11 月 29 日宣布旗下 lecanemab 的大型全球 3 期验证性 Clarity AD 临床试验结果,lecanemab 是一种高专一性的抗体药物,对短原纤维状结构的类淀粉蛋白(protofibril Aβ)有高亲和力,在细胞与动物试验中发现有优良的神经保护性、Aβ结合力与Aβ清除能力,用于治疗由阿兹海默症 (Alzheimer’s Disease, AD) 以及轻度阿兹海默症(mild Alzheimer’s Disease, mAD,亦或称为早期阿兹海默症,early AD)所引起的轻度认知障碍 (mild cognitive impairment, MCI) ,此次的试验确认大脑淀粉样蛋白沉积结果,将发表于旧金山市所举行的 2022 年阿兹海默症临床试验 (2022 Clinical Trials on Alzheimer’s Disease , CTAD) 会议上。
Biogen 在公布阿兹海默症试验的阳性数据前达成 9 亿美元和解 (基因线上国际版)阿兹海默症(Alzheimer’s disease, AD)会影响病人生活品质
AD 是一种进行性神经系统疾病,该疾病会导致记忆,思考和行为问题,严重影响罹患这种疾病的人及其亲人。随着全球年龄老化人口的增加,AD 已成为社会和医疗保健系统的一个关键问题。目前对于早期 AD 的治疗目标是对认知功能、日常生活活动和精神症状产生持续影响,通过减缓疾病进展而维持病人更长时间的独立性,并改善或维持其生活品质。
CLARITY AD 试验分析
Clarity AD 是一项全球验证性 3 期安慰剂对照、双盲设计、随机分派试验,共于北美、欧洲和亚洲的 235 个地点纳入 1,795 名早期 AD 病人(lecanemab 组:898 人,安慰剂组:897 人)进行试验。病人按 1:1 随机分配接受安慰剂或 lecanemab 10 mg/kg 静脉注射,每两周一次。同时,这些病人亦根据以下条件如 AD 或轻度 AD 所导致的 MCI、试验前是否使用核准的 AD 症状药物(例如 acetylcholinesterase inhibitors、 memantine 或两者)、ApoE4 突变型态和地理区域进行次族群分层。 由于 Clarity AD 试验中的多元化招募策略,美国受试者中分别有 4.5% 和 22.5% 为黑人及西班牙裔。
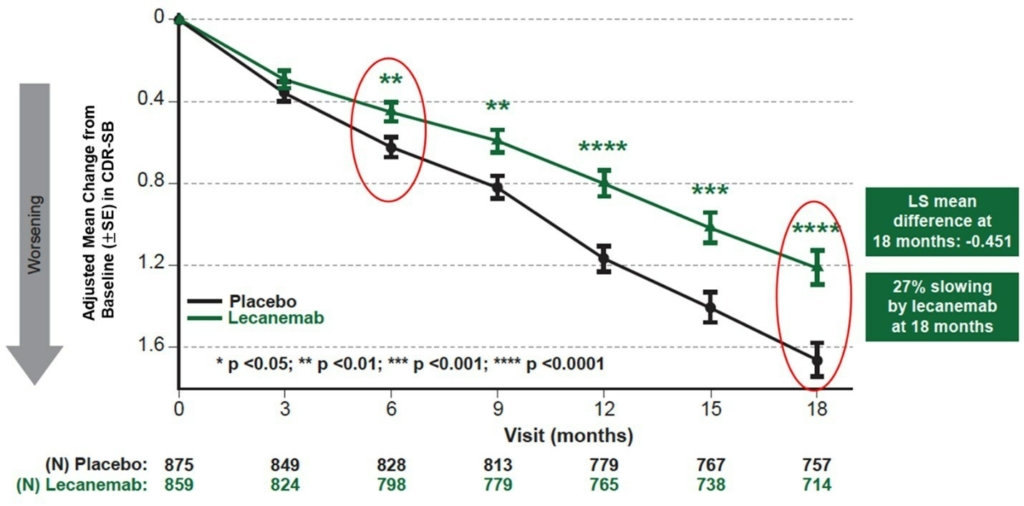
试验的主要评估指标为 18 个月之临床失智评估量表(Clinical Dementia Rating Sum of Boxes, CDR-SB)。次要评估指标为 18 个月以 Centiloids 进行淀粉样蛋白正子断层造影 (Positron Emission Tomography, PET) 、AD 评估量表 – 认知分量表 14 (AD Assessment Scale – Cognitive Subscale 14, ADAS-Cog14)、AD 综合评分 (AD Composite Score, ADCOMS3) 和 AD 合作研究 – 轻度认知障碍日常生活量表活动 (AD Cooperative Study-Activities of Daily Living Scale for Mild Cognitive Impairment, ADCS MCI-ADL4)。
试验结果显示, 从基线至 18 个月 CDR-SB 的平均变化对于 lecanemab 组和安慰剂组分别为 1.21 和 1.66。Lecanemab 治疗在 18 个月时减低 -0.45 全球认知和功能量表指数(95% 信赖区间 (CI):-0.67,-0.23;P=0.00005),这意味着下降速度放缓 27%,达到统计上显著差异。 最早从六个月开始(差异:-0.17 [95% CI:-0.29,-0.05];P<0.01),并且之后每 3 个月随着时间的推移而增加的绝对差异,相较于安慰剂,lecanemab 治疗都显示 CDR-SB 具达到统计上显著差异 (所有 p 值均小于 0.01)。(如图一所示)
此外,所有的次要评估指标相较于安慰剂组,皆达到统计上显著差异(p < 0.001)。在淀粉样蛋白 PET 次分析中,lecanemab 治疗显示,从 3 个月开始的所有时间点,淀粉样蛋白斑块负荷均显著降低,达统计上差异。 Lecanemab 组和安慰剂组在 18 个月时 Centiloids 的平均变化分别为 -55.5 和 3.6(平均差:-59.1 [95%CI:-62.6,-55.6];P<0.00001); Lecanemab 亦于 18 个月时将 ADAS-Cog14 的认知功能减缓 26%(平均差:-1.44 [95%CI:-2.27,-0.61];P=0.00065)。在 ADCOMS 评估中,lecanemab 组在 18 个月时减缓疾病进展 24%(平均差:-0.050 [95% CI:-0.074,-0.027;P=0.00002])。 在 18 个月时,Lecanemab 亦使 ADCS MCI-ADL 的日常生活活动指数减慢约 37%(平均差:2.016 [95%CI:1.208,2.823];P<0.00001)。次族群分层中所有评估指标也显示与上述结果类似。
在安全性评估上,lecanemab 组最常见的不良事件 (>10%) 为输液反应(lecanemab:26.4%;安慰剂:7.4%)、ARIA-H(合并脑微出血、脑大量出血和表层铁质沉积;lecanemab 组:17.3%;安慰剂组 :9.0%)、ARIA-E(水肿/积液;lecanemab 组:12.6%;安慰剂:1.7%)、头痛(lecanemab 组:11.1%;安慰剂:8.1%)和跌倒(lecanemab 组:10.4%;安慰剂:9.6%)。输注反应主要是轻度至中度(1-2 级:96%),并且常发生在第一次给药时 (75%)。
在试验期间,lecanemab 组和安慰剂组分别有 0.7% 和 0.8% 的受试者死亡,没有死亡案例与 lecanemab 相关或与淀粉样蛋白相关成像异常 (amyloid-related imaging abnormalities, ARIA) 相关 。Lecanemab 组中约 14.0% 以及安慰剂组约 11.3% 的受试者通报过严重不良事件。整体来说, lecanemab 组和安慰剂组分别有 88.9% 和 81.9% 的受试者于治疗中发生过不良事件。 此外,在 lecanemab 组和安慰剂组中,分别约 6.9% 和 2.9% 的受试者发生因不良事件出现而导致停药的比例。
综上所述,相较于安慰剂组,lecanemab 组证明对于认知和功能以及次族群分层(种族、民族、合并症)的结果达一致性统计上差异。 透过全球 CDR 评估(风险比:0.69)。Lecanemab 治疗将转化至下一阶段疾病的风险(轻度到中度,甚至重度 AD)降低约 31%。根据所观察 CDR-SB 数据进行外推分析至 30 个月可见,lecanemab 组需要 25.5 个月才能与安慰剂组在 18 个月时所达到的疾病状况相同,这意味着治疗组可减缓疾病进展约 7.5 个月。
延伸阅读:解决阿兹海默症病人躁动问题!Axsome Therapeutics 旗下 AXS-05 数据达标!参考资料:
https://www.prnewswire.com/news-releases/eisai-presents-full-results-of-lecanemab-phase-3-confirmatory-clarity-ad-study-for-early-alzheimers-disease-at-clinical-trials-on-alzheimers-disease-ctad-conference-301689627.html
https://www.eisai.com/news/2022/news202285.html
©www.geneonline.news. All rights reserved. 基因线上版权所有 未经授权不得转载。合作请联系:service@geneonlineasia.com