2019 BioJapan 是日本生物制药和再生医学产业的重要展会,也是日本与亚洲各国连结国际的重要平台,会中也有许多精彩的专题演讲,有来自 34 个国家、1,200家公司和组织参加。基因线上特别整理抗体和核酸药物发展与趋势的最新临床应用及未来展望。
次世代抗体技术与药物开发
Switch 抗体技术 提升癌症免疫疗法专一性及安全性
虽然抗体药物不断创新,但仍可能会有脱靶产生细胞毒性的疑虑。因此,Chugai Pharmabody Research 开发出一种 Switch 抗体技术,它需先结合疾病中的特定代谢分子才能与抗原结合。ATP 是一个称职的 Switch 代谢分子,它在肿瘤微环境中的细胞外浓度大于 100 M,远高于正常组织的细胞外浓度 30 nM。在他们的小鼠模型研究中,证实 Switch 抗体能够在高 ATP 实体瘤微环境下与标靶抗原结合,而不会与正常组织或血浆中的抗原结合,专一性优于一般体,且抑制肿瘤效果优于非 Switch 抗体。简言之,Switch 抗体技术提升癌症免疫疗法的专一性及安全性。
免疫细胞受体数据库建立 推动个人化治疗进展
每个人因其免疫细胞受体(TCR、BCR)辨识抗原的能力不同,感染防御能力、自身免疫性疾病和癌症痕迹也有所不同。若能建立含有 TCR、BCR 的免疫数据库,就能提供相关数据辅助人们进行抗原侦测、细胞治疗和药物开发、诊断和预测。免疫数据库的建立从收集正常细胞、肿瘤细胞、其余免疫疾病细胞开始,然后透过高通量结构建模 AI 软件和单细胞分析技术分析其 TCR、BCR 的结构、基因表现、功能。简言之,该数据库不仅帮助生技业者开发抗体新药,也能推动个人化免疫治疗的进展。
VHH 抗体药物临床进展
重链抗体(heavy chain antibody, HcAb)是存在于骆驼科动物内、不包含轻链且仅由一个重链可变区组成的新型抗体分子(heavy chain variable domain of heavy-chain antibody, VHH)。VHH 抗体的相对分子量为 12 K,相当于普通抗体的 1 /14 (170K),它可在大肠杆菌中表现,且具有容易编辑和热稳定性高的特点。因此,它兼具传统抗体与小分子药物的优势,克服传统抗体的开发周期长、稳定性较低,保存条件严格等缺点。2018 年,欧盟核准第一个 VHH 抗体药物 Cablivi(caplacizumab)上市,隔年美国 FDA 核准 caplacizumab 上市。目前正在进行临床试验的 VHH 抗体药物有 ozoralizumab、M1095、vobarilizumab、LCAR-B83M 等(表一)。
表一、VHH抗体药物临床现况(2020/05/04更新)
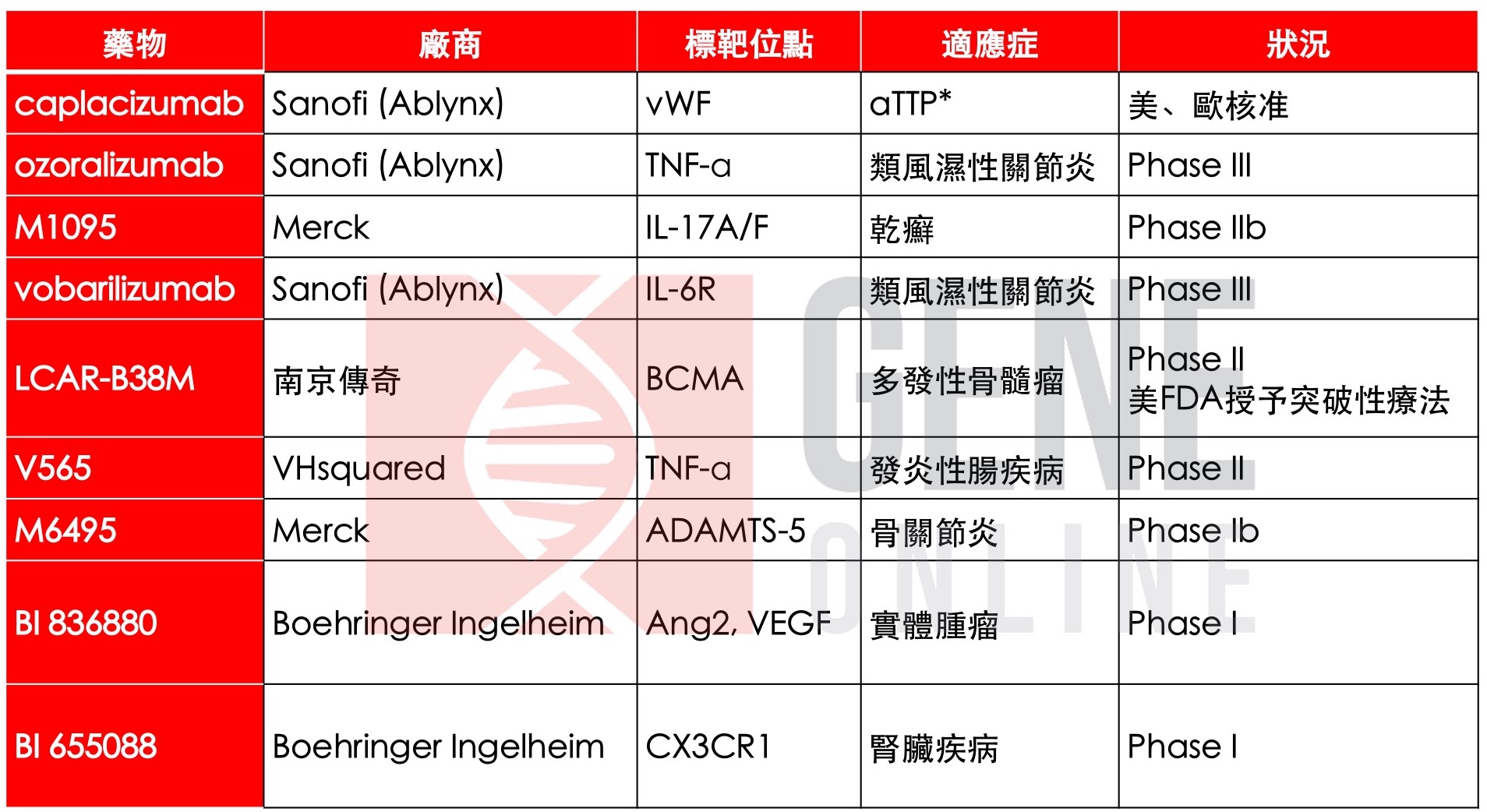
* aTTP: 后天性血栓性血小板减少性紫癜 (acquired thrombotic thrombocytopenic purpura)
核酸药物
修饰主链立体化学结构以优化寡核苷酸药物
反义寡核甘酸(antisense oligonucleotide, ASO)会与 mRNA 互补配对后,招募 RNase H,后者再标靶 mRNA 进行剪切,阻断它进行转译成蛋白。然而,单核甘酸多型性(single nucleotide polymorphism, SNP)会降低 RNase H 的活性和准确性,而产生错误配对。因此,透过主链立体化学修饰,解决上述配对错误的问题。另外,主链立体化学修饰也提升外显子跳跃(exon skipping)寡核苷酸的活性。例如,使用主链立体化学修饰的 ASO 促进 2A型Usher 症候群(遗传眼科疾病)病人的USH2A 外显子13 跳跃,以达到治疗的效果。
突破 RNAi 药物运输的挑战 以 Onpattro 为例
一般来说,将 RNAi 药物准确地运输到器官、细胞、甚至细胞质上,仍是需要面对的挑战。第一个获得 FDA 和欧盟核准的RNAi 药物 Onpattro,则是成功的案例,它是使用 RNAi 将脂质纳米颗粒(lipid nanoparticles, LNPs)的方法,将它输送到肝脏,治疗遗传性多发性神经病变。该 LNPs 包含 DLin-MC3-DMA、PEG2000-C-DMG、DSPC 和胆固醇等四种脂质赋形剂,可保护活性成分 ALN-18328 不被循环系统中核酸内切酶和核酸外切酶的降解。接着,Onpattro 需透过载脂蛋白 E(apolipoprotein E)精准地与肝细胞上的低密度脂蛋白受体结合,随后发生胞吞作用,siRNA 再标靶至 TTR mRNA 上,以降解它,达到治疗效果。
反义寡核苷酸(ASO)治疗脊髓性肌肉萎缩症
脊髓性肌肉萎缩症(spinal muscular atrophy, SMA)为一种体染色体突变所造成的遗传性疾病,当其二条染色体的 SMN1 基因都缺失时,才会发病。SMN2 基因具有补偿性的效果,当 SMN1 基因缺陷时,SMN2基因子量越多,越能延后及缓解 SMA 的症状发生。Nusinersen 是一种反义寡核苷酸(ASO),注射到围绕脊髓,能改变或修正 SMN2 mRNA的剪接,以增加完整的 SMN 蛋白制造。该药于 2016 年获 FDA 核准上市,日本也于 2017 年核准它上市。因此,SMA 基因体研究和nusinersen,可作为未来药物开发治疗神经性疾病的参考模型。
异源双链寡核苷酸药物
异源双链寡核苷酸(heteroduplex oligonucleotide, HDO)是一种全新的寡核苷酸药物。有别于 siRNA的双链RNA 和 ASO的单链DNA,HDO由 DNA/LNA 及其互补RNA(cRNA)组成。在小鼠实验中,以 tocopherol 作药物载体,分别结合 ASO 、HDO 的cRNA,比较二者运输效果。结果显示,tocopherol 结合 HDO 组的HDO向肝脏的运输成效为 tocopherol 结合 ASO 组的 4.8 倍。另外,以 tocopherol 结合 HDO 组,能通过血脑障壁(BBB),有效抑制每一个脑部区域的 Malat-1 基因表现达 70%-90%。总结以上,HDO 不仅提供了一个新颖的治疗肝脏和脑部疾病的新方法,更为核酸药物开辟了新的视野。
延伸阅读:BioJapan 2018 精彩回顾:核酸药物进行式总结
日本生物制药研究和产业发展都为世界领先者,仅次于欧美, 特别是抗体和核酸研究已耕耘多年,期望在未来创造巨大的生物经济。
©www.geneonline.news. All rights reserved. 基因线上版权所有 未经授权不得转载。合作请联系:service@geneonlineasia.com