名列 2021 年十大發展潛力新藥之一的必治妥施貴寶(Bristol Myers Squibb,BMS)旗下乾癬藥物deucravacitinib,不負眾望終於在 2021 年進入倒數一個月時獲得美國食品藥物管理局(FDA)接受其新藥申請(NDA),進入審查程序。
該藥用於治療中度至重度斑塊型乾癬成人患者,根據處方藥使用者付費法(PDUFA),目標日期指定為 2022 年 9 月 10 日。
什麼是 deucravacitinib?
Deucravacitinib 是一種口服的選擇性酪氨酸激酶 2(TYK2)抑制劑,是第一個也是唯一一個臨床上的選擇性 TYK2 抑制劑,同時,也將是第一個被批准用於治療任何疾病的 TYK2 抑制劑。在治療劑量下,deucravacitinib 不會抑制JAK1、JAK2 或 JAK3。
Deucravacitinib 優於 apremilast 及安慰劑
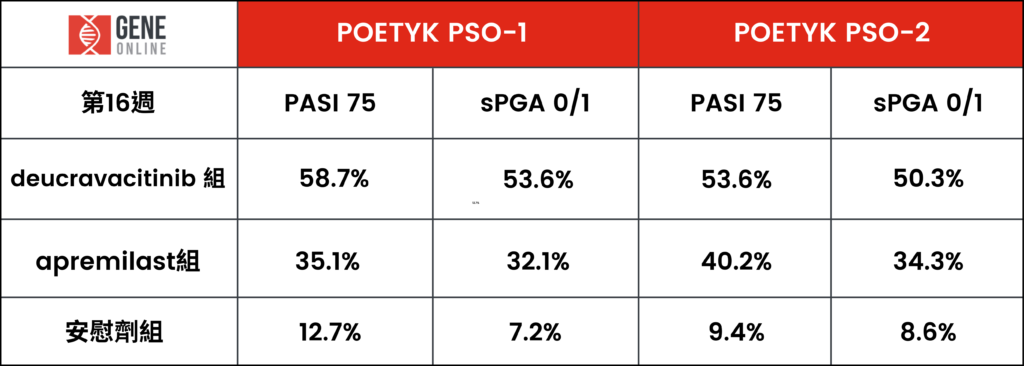
FDA 該項核准是基於 POETYK PSO-1 與 POETYK PSO-2 的臨床試驗III期的正面結果,該試驗評估 deucravacitinib 在中度至重度乾癬患者中的療效及安全性。
患者被隨機分配接受 deucravacitinib 6毫克,每日口服一次;apremilast 30 毫克,每日口服兩次或安慰劑。POETYK PSO-1 共招募 666 名患者、POETYK PSO-2 共招募 1,020 名患者。POETYK PSO-1 與 POETYK PSO-2 的共同主要終點為,與安慰劑相比,在第 16 週達到 PASI 75(乾癬面積及嚴重程度指數改善75%)反應,以及 sPGA 0/1(醫師靜態總體評估,評分 0 代表皮膚完全清潔;1 代表皮膚接近清潔)的患者百分比。
次要終點包括與 apremilast 相比,在第 16 週與第 24 週達到 PASI 75、sPGA 0/1 的患者百分比。結果發現,在第 16 週時無論與安慰劑或是 apremilast 相比,deucravacitinib 組的患者皆有較高百分比達到 PASI 75 及 sPGA 0/1 的目標。
安進公布治療生殖器乾癬最新臨床試驗數據
就在 BMS 宣布此消息的兩天後,競爭對手安進(Amgen)便公布 apremilast 針對中度至重度生殖器乾癬治療效果的臨床試驗第 III 期數據,達到主要終點與次要終點,「具有臨床意義及統計學意義的改善」,試圖鞏固乾癬治療市場的地位。
不過今年 9 月 FDA 曾經針對 JAK 抑制劑包括 Xeljanz/Xeljanz XR(tofacitinib)、Olumiant(baricitinib)以及 Rinvoq(upadacitinib)提出安全性警示,可能增加嚴重心臟相關事件、癌症、血栓及死亡風險。雖然 deucravacitinib 是更獨特的作用機制,但仍屬於早期開發階段,醫界認為需等待更長的時間觀察其臨床療效真實數據。
審查程序預計約 10 個月
因應藥品大量上市申請案件,早於 1992 年美國 FDA 便公告 PDUFA,藥品與生物製劑類產品製造廠申請上市前審查、設廠及藥品生產,須付審查費用,此機制使得FDA可聘用更多專業審查人員及取得豐富資料,以改善審查效率、縮短審查時間。
審查程序的目標完成日期即為批准日期,通常為自收件後 10 個月,會有變化,延長或提前皆可能;若獲得優先審查資格,則可能縮短為 6 個月。deucravacitinib 目前預計完成審查的目標日期為 2022 年 9 月 10 日。
延伸閱讀:雙特異性抗體抗腫瘤前景好!BMS 取得 Agenus 專屬授權參考資料:
- https://www.businesswire.com/news/home/20211129005192/en/Bristol-Myers-Squibb%E2%80%99s-Applications-for-Deucravacitinib-for-the-Treatment-of-Moderate-to-Severe-Plaque-Psoriasis-Accepted-by-U.S.-Food-and-Drug-Administration-and-Validated-by-European-Medicines-Agency
- https://www.prnewswire.com/news-releases/amgen-announces-positive-top-line-results-from-otezla-apremilast-phase-3-discreet-study-in-moderate-to-severe-genital-psoriasis-301435620.html
- https://www.fda.gov/safety/medical-product-safety-information/janus-kinase-jak-inhibitors-drug-safety-communication-fda-requires-warnings-about-increased-risk
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com