心血管疾病除了会严重危害患者生活品质并大幅增加国家医疗负担,其死亡率在各国也长期稳居十大死因的前三名。尽管外科手术、药物、以及监测工具日新月异,也能有效延长患者寿命,但已经受损的心脏或血管组织仍难以恢复至健康状态。即使心脏移植能拯救严重心脏衰竭病患,但一“心”实在难求,故寻找其他疗法实乃刻不容缓。这十几年来,基因操作技术的长足进步使得基因疗法被寄予厚望,不过目前为止尚未有明确进展。究竟过去为什么失败,未来该怎么发展?鉴往,或许有助于知来。
过去心血管疾病基因治疗临床试验所遭遇的挫折
自 2002 年的 AGENT 临床试验开始 [1] ,基因治疗尝试用于人类心血管疾病已经有十年以上的历史。试验结果多显示基因疗法无明显的安全性疑虑,但对于相关症状和指标却也没有显著改善。以 AGENT 试验为例,检测的疗法是为心血管疾病患者以导管注射纤维母细胞生长因子 4 互补 DNA (FGF-4 cDNA) 的腺病毒载体至冠状动脉,期望能加速新血管生成以恢复缺血心肌的血液及养分供应。尽管这项疗法顺利通过第一与第二期临床试验的安全性和初步疗效考验,但第三期之 AGENT-3 及 AGENT-4 试验 (2007 年) 却因治疗组与对照组在跑步机运动的表现无显著差异而被迫提前中止 [2]。
类似情况也发生在 CUPID 试验。肌浆网是肌肉的钙离子储存槽,受到神经电讯号刺激就会将钙离子释出至肌细胞促其收缩,收缩过后则必须把钙离子收回肌浆网,肌肉才能放松以准备进行下次收缩。心脏衰竭有一部份的原因就是上述钙离子循环无法正常运作,故 CUPID 试验以腺病毒将肌浆网 Ca2+-ATP 酶 2a (SERCA2a) 送入心肌细胞,希望可以恢复健康的钙离子流动。但同样在经过第一期临床试验确保其安全性后,第二期的随机分派、双盲试验也因为主要评估指标 (治疗后到心脏衰竭住院并且发生死亡、心脏移植、植入左心室辅助器材、或步行能力下降的时间) 在治疗组和对照组之间无显著差异而不得不终止 [3]。
延伸阅读:突破基因治疗困境的希望之星:球型核酸 (上)鉴往:针对过去临床试验失败的检讨与改进
以上的试验失败可能与载体选择、给药频率、给药途径、目标基因选择,甚至是种族、性别、年龄等因素相关。另外,这些疗法当初都是在年轻的动物完成临床前试验,但实际临床试验多是招募病情较严重或年纪较大的病患,而此时血管内皮再生或钙离子循环改善等局部变化可能不足以提升整体运动机能。受试者也可能因为其他生理结构老化或恶化太快,因而盖过治疗进步幅度,导致临床效果不显著。
知来:新技术带来的新希望
由以上分析可知,设计试验时须明确制定患者族群,同时也需要设计不易受其他因素干扰的评估指标。也许基因疗法只适合刚发生心血管疾病的青壮年患者,不适合用于长期罹患心脏衰竭的年迈患者。又诸如跑步机运动表现这类的临床评估指标,其实可推想每个人的运动表现本来就有其个别极限,没有生病前连400公尺都跑不到的人,很难想像用基因治疗后就能突飞猛进,这是不可能的。故利用心脏磁振灌流造影 (cardiac magnetic resonance perfusion imaging) 与正子摄影 (PET) 等进阶影像工具,或许可以更客观、细致地侦测生理变化,进而验证基因治疗的效果。
虽然基因治疗至今为止可说是失败重重,但新技术仍持续问世,也陆续发现各种极具潜力的新基因标的,像是在调控细胞复制、分化、钙离子恒定、心肌收缩力、及凋亡皆占有一席之地的 S100 蛋白质家族基因 [4]、可调控心脏功能并防止心肌细胞 DNA 损伤与细胞凋亡的 BRCA1 基因 [5]、抑制细胞凋亡的 Fas 蛋白之 anti-Fas 基因 [6],和可诱导干细胞发挥修复功能的 SDF-1/CXCR4 路径相关基因 [7-9] 等。未来的趋势也将是针对一整套基因进行调控 (如 VEGF 加 Ang-1) [10],因为单一基因的改变也许不足以逆转大局。
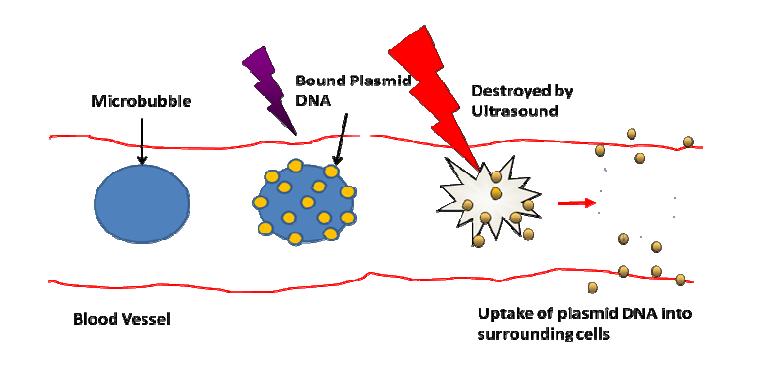
超音波微气泡转染 (ultrasound-targeted microbubble destruction, UTMD) ,来源:http://stephanieschaefer.ca/2011/01/ultrasound-targeted-microbuble-destruction/
另外,为避免基因治疗偏离标的,超音波微气泡转染 (ultrasound-targeted microbubble destruction, UTMD) 在近几年逐渐崭露头角。其原理是将含特殊基因的载体置入微气泡,再以心导管打到受损心肌附近,藉超音波诱导微气泡至目标组织,然后于适当时机诱发微气泡破裂让基因进入心肌细胞。其优点有低侵入性、低毒性、低致敏性、与能够针对特定目标进行转染;缺点则包括微气泡体积过大不易穿过血管壁,以及稳定存在时间过短而需要多次给药以加强疗效。此技术在动物实验已获得许多令人振奋的成果,故研究人员正积极评估用于人类基因治疗的可行性 [11]。未来希望借由不断推陈出新的技术,加上从过去失败汲取的宝贵经验,最终可让更多受苦受难的心血管疾病患者能借由基因治疗,重获光明的人生。
©www.geneonline.news. All rights reserved. 基因线上版权所有 未经授权不得转载。合作请联系:service@geneonlineasia.com
参考文献:
1. Grines CL et al. Circulation 2002; 105:1291-7.
2. Henry TD et al. J Am Coll Cardiol 2007; 50:1038-46.
3. Greenberg B et al. JACC Heart Fail 2014; 2:84-92.
4. Imbalzano E et al. Heart Fail Rev 2016; 21:463-73.
5. Shukla PC et al. Nat Commun 2011; 2:593.
6. Miyata S et al. Am J Pathol 2010; 176:687-98.
7. Ratajczak MZ et al. Stem Cells 2003; 21:363-71.
8. Pyo RT et al. J Mol Cell Cardiol 2006; 41:834-44.
9. Chen J et al. Am J Pathol 2010; 176:1705-15.
10. Smith AH et al. J Am Coll Cardiol 2012; 59:1320-8.
11. Ferrara K et al. Annu Rev Biomed Eng 2007; 9:415-47.


