文 / Jane Weng
基因编辑技术对于近代医疗及科学研究的进步有极大贡献。从发现DNA的双螺旋构造到拥有人工合成核酸等技术,科学家为了解开基因存在的意义,尝试了许多种基因编辑技术,希望借着分析各个基因的机能,了解人类疾病的病因并且做为未来治疗的方法。
在现在广泛被应用的研究技术当中,可以很容易的在培养细胞上强制表现 (Overexpression) 或抑制 (Suppression) 某个特定基因。但是在培养皿中观察到的现象多半与体内的生理状态大有差异,尤其是使用 siRNA 或 shRNA 的基因抑制 (gene suppression) 实验更容易有脱靶 (off-target) 效应的问题。若想要在实验动物的基因体上将某个基因剔除 (Knockout),传统的方式需要一定程度的经费与时间。
为了能够更精准快速地调控基因,近年来,科学家们不断的开发新的基因编辑技术,例如 Zinc finger nuclease (ZFN) 或是 TALEN (Transcription activator-like effector nuclease) 便是能够准确切断目标双链 DNA 的核酸酶。然而,这两种方法却因为合成的难度与费用昂贵,难以达到普及。
CRISPR-cas9 带领基因编辑技术进入新时代
CRISPR 序列是细菌独有的适应性免疫系统 (Adaptive immunity),原本被发现于细菌的 CRISPR 基因座上(CRISPR loci),细菌被感染时,他们利用自己独有的 CRISPR 免疫系统,将外来 DNA 截断并记忆于 CRISPR 序列与序列之间,当再次被感染时,细菌便能即时辨识并诱导 Cas 核酸酶 (Endonuclease) 剪断目标,避免细菌再度被感染。
在 2013 年,美国 Broad Institute 的 Zhang 团队与哈佛大学的 Church 团队同时发表:CRISPR-cas9 系统也可以作用于真核生物 (Eukaryotes) 的基因体中,切断目标的基因。而现今的 CRISPR-cas9 也成为普遍的基因编辑工具:研究者只需要利用搭载有 CRISPR 序列以及 Cas9 核酸酶的 plasmid,并设计自己想要剔除的目标基因的序列作为 guide RNA 序列 (guide DNA sequence) 放入其中,再导入于培养细胞或实验动物的受精卵中,便能够将目标基因切断而达到抑制基因表现的目的 。加上真核生物 (Eukaryotes) 本身并没有 CRISPR-cas9 系统,因此对于内生的传导途径 (Endogenous pathways) 也比较不会有影响。基于种种优点,CRISPR-cas9 技术已经普遍使用于各种研究领域,不单是基础科学及药物目标筛检,未来也希望能够应用在临床医疗上。
CRISPR-cas9 的限制
CRISPR-cas9 虽然有许多优点,却仍然有许多使用上的限制。
(1) Cas9 核酸酶是透过辨认基因上的一组三核甘酸 – Protospacer Adjacent Motif(PAM)来锁定目标的,而 Cas9 核酸酶所能辨认的三核甘酸必须是 Guanine-rich (鸟嘌呤) 的部位,这个限制会让目标切点的选择减少。
(2) Cas9核酸酶切割双股DNA会产生平滑末端(Blunt end) 的形式,再借由同源重组修复系统(Homologous recombination, HR)或非同元的黏合系统(Non-homologous end-joining, NHEJ)的方式修复DNA。利用细胞的修复机制可以将欲编辑的序列趁机编入,达成基因编辑的目的,但是Blunt-end的基因编辑却较为困难。
(3) Cas9核酸酶的切点靠近作为辨识的三核甘酸(PAM),所以Cas9很可能将PAM一起切除,让第二阶段的应用无法实行。
也因为这些原因,研究CRISPR系统的专家们也极力探索解决的方法,并同时开发其他同样具有基因编辑能力的核酸酶。
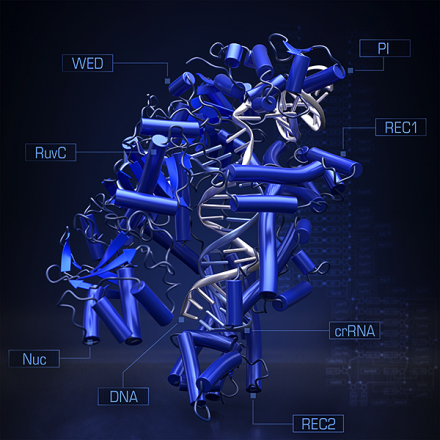
图为 CRISPR-Cpf1 与 guide-RNA, target-DNA 的结晶体
CRISPR 的新剪刀:Cpf1
2015 年,发现 CRISPR-cas9 具有剪辑真核生物功能的 Zhang 团队发现了与 Cas9 同类的核酸酶: Cpf1。
Cpf1 与 Cas9 相同,也是 RNA-guided 核酸酶。不同于 Cas9 需要两个 RNA 序列,Cpf1 只需要guided-RNA 一个序列。Cpf1 同样有辨认基因用的三核甘酸 (PAM),相较于 Cas9 的 G-rich PAM,Cpf1 的 PAM 以 Thymidine (胸腺嘧啶)为主,这个差异可以让使用者有较多元的选择,依照自己想编辑的基因挑选适当的核酸酶。而且,Cpf1 的 PAM 离它切点有一段距离,让第二阶段的调控更简单。
Cpf1 最主要的优点在于它的 DNA 切断方式会产生黏状末端 (Sticky end),让接下来的基因插入或编辑更加准确(Zetsche et al., 2015)。虽然 Cpf1 作为研究工具还无法实际应用,但是目前的研究显示 Cpf1 的特性与 Cas9 刚好成为互补,只要能更进一步了解 Cpf1 的立体构造,便能够开发 Cpf1 成为 CRISP R基因编辑技术的新剪刀。
2016 年 4 月,Zhang 研究团队与日本东京大学的濡木 (Nureki) 教授的研究团队共同合作,成功地将Cpf1 与 Guide RNA 以及 Target DNA 复合体的构造结晶化 (Yamano et al., 2016)。同时,中国的Zhiwei Huang 研究团队也公布了 Cpf1 与 CRISPR-RNA 结合的结晶构造 (Dong et al., 2016)。这项研究成果将让 CRISPR-cpf1 系统的开发更进一步。多了不同功能的核酸酶,未来的 CRISPR 技术将有可能取代现有传统的基因调控技术,而临床上的应用更是指日可待。
图为Cpf1与Cas9的比较表
©www.geneonline.news. All rights reserved. 基因线上版权所有 未经授权不得转载。合作请联系:service@geneonlineasia.com
延伸阅读:CRISPR 2.0 可微调的基因修饰技术参考文献:
1.Hsu et al., 2014, Cell 157, 1262-1278. “Development and Applications of CRISPR-cas9 for genome engineering”.
2.http://www.jst.go.jp/pr/announce/20160422/
3.Zetsche et al., 2015, Cell 163, 759-771. “Cpf1 is a single RNS-guided endonuclease of a class 2 CRISPR-cas system”.
4.Yamano et al., 2016, Cell 165, 949-962. “Crystal structure of Cpf1 in complex with guide RNA and target DNA”.
5.Dong et al., 2016, Nature 532, 522-526. “The crystal structure of Cpf1 in complex with CRISPR RNA”.
图片来源:
http://www.jst.go.jp/pr/announce/20160422/
http://labiotech.eu/crispr-patent-war-end-discovery-new-editing-protein-cas9/