随着新冠肺炎(COVID-19)在全球大流行,研究人员正在争分夺秒地开发诊断工具、疫苗和治疗方法。目前约 40 多种疫苗的临床试验正在进行中,专家评估最快也需半年才上市。另外,多家学术机构、非营利机构和生物制药公司也一直在利用 CRISPR技术的优势,以增强 COVID-19 药物的开发,并且开发快速诊断方式。
CRISPR 于 COVID-19 诊断之现况
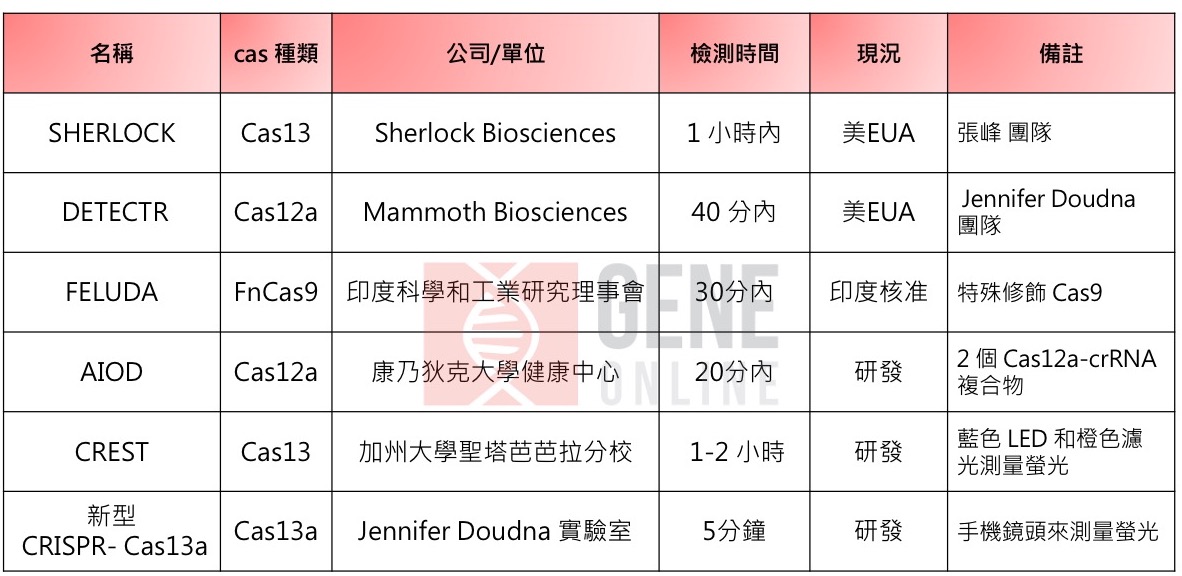
目前,COVID-19 的检测能力受到许多因素的限制,例如复杂程序,对实验室仪器的需求以及对有限供应的依赖。因此,迫切需要快速检测试剂盒。2018 年起,CRISPR 已经被科学家们开发应用于传染病和其病原体(细菌和病毒)诊断,主要透过引导 RNA 与 Cas 家族蛋白的结合,该蛋白可切割标靶并切碎附近的 RNA 或 DNA,再透过恒温环状扩增法(loop-mediated isothermal amplification, LAMP)。当 CRISPR 命中目标时,报告分子释放萤光讯号,可以透过侵入性患者检体(例如血液、尿液或唾液)的检测试纸来进一步对此进行分析。目前有 SHERLOCK、DETECTR 等系统已经获得 FDA 紧急使用授权,FELUDA 获得印度药品总局核准使用,而 AIOD、CREST 等系统已发表于期刊,待进一步商业化。
EUA:紧急使用授权
1. SHERLOCK
SHERLOCK CRISPR SARS-CoV-2 检测试剂组已经于 2020 年 5 月取得美国 FDA 紧急使用授权于诊断 SARS-CoV-2,该系统主要借由 Cas13 切割,并且可以装载到纸条上,类似于怀孕测试,非常容易使用,可直接用肉眼观察结果且无需昂贵设备,因此在任何环境中进行快速简单的检测,可在大约 1 小时内提供结果。
该检测试剂组主要检测 SARS-CoV-2 的开放读序框架(open reading frame, ORF1ab,DNA上会产生蛋白质部分)基因和核壳蛋白(nucleocapsid protein, N)基因中的片段。
该系统由布洛德研究所(Broad Institute)的张峰(Feng Zhang)博士及其团队所研发,并由其公司 Sherlock Biosciences 所发表。
2. DETECTR
由诺贝尔化学奖新科得主 Jennifer Doudna 教授和 Trevor Martin 共同创办的Mammoth Biosciences 研发的 SARS-CoV-2 DETECTR Reagent Kit 于 2020 年 8 月底取得美国 FDA 紧急使用授权于诊断 SARS-CoV-2。
该检测试剂组主要使用 Cas12a 进行切割,而不是 Cas9,并且结合等温扩增以提高 attomolar 灵敏度和特异性,来检测上呼吸道检体中的 SARS-CoV-2 的核壳蛋白(nucleocapsid protein, N)的片段基因,将不需要复杂的实验室环境、大型设备和耗时多步骤过程,可在 40 分钟内提供结果。在 83 个 SARS-CoV-2 阳性检体中,使用该检测方法再度检验,其阳性预测率达 95%,阴性预测率达 100%。
延伸阅读:Mammoth Biosciences开发第一个CRISPR疾病检测平台3. FELUDA
FELUDA(FnCas9 Editor Linked Uniform Detection Assay)是由印度科学和工业研究理事会的Debojyoti Chakraborty、Souvik Maiti 和 Tata Group 所领导的研究团队开发。他们使用 CRISPR-FnCas9 进行检测,在不到30分钟内可获得检测结果,其灵敏度为96%,特异性为98%。其中 FnCas9 对 DNA 中配对错误的存在以及这些错配的位置呈现高度敏感。
他们使用生物素化的引子透过 PCR/RPA 扩增标靶序列,然后用链亲和素(streptavidin)包覆的珠子将它们固定。再来,将包含没有错配的sgRNA的萤光标记dCas9复合物与固定的标靶序列结合。结合后,可以看到萤光的变化。另一种方法是将相同的概念应用于包含可与生物素化标靶(biotinylated targets)结合的链亲和素的侧流试纸条。
4. AIOD
AIDO (All-In-One Dual CRISPR-Cas12a)是由康乃狄克大学健康中心生物医学工程系 Changchun Liu 副教授的研究团队开发的一种“多合一双重 CRISPR-Cas12a 检测技术”,以使用低成本的暖手器作为培养箱,不需要昂贵电子设备,可在 20 分钟内得到检测结果。该检测方法也经过 RT-PCR 验证,能获得一致的结果,未来可望应用在家庭或小型诊所。
他们透过标靶 SARS-CoV-2 的核蛋白基因,引入了 2 个没有原型间隔子相邻基序(protospacer adjacent motif, PAM)位点限制的 CRISPR RNA,以开发AIOD-CRISPR 分析,并且其能检测具有少量拷贝敏感性的核酸。
5. CREST
CREST(Cas13-based, Rugged, Equitable, Scalable Testing)由加州大学圣塔芭芭拉分校 Maxwell Z Wilson 助理教授所开发。首先,提取 RNA 并进行反转录。然后使用 Taq 聚合酶通过PCR进行扩增,然后转录以提供 Cas13的 RNA 基质。在发现 gRNA 与给定的萤光标记基质之间存在互补性后,Cas13被活化并进行非特异性的侧链切割。该切割与萤光可视化耦合。然而,他们没有使用侧向流动条来检测萤光标记的RNA的裂解,而是使用了由9V电池供电的 P51 纸板萤光视觉化仪器,该电池使用蓝色 LED 和橙色滤光片来检测裂解后的萤光。整个流程,大约需要 1-2 小时。
另外,他们没使用典型的 PCR 仪器,而是使用了价格低廉、可现场使用、支持蓝牙的 PCR 仪器,它们甚至可以由电池供电,并且可以透过 DIY-Bio 机芯进行操作。
6. Jennifer Doudna 教授推新型 CRISPR- Cas13a 检测
Jennifer Doudna 教授的实验室近日也推出新型 CRISPR-Cas13a 检测,仅需 5分钟即可检测到 SARS-CoV-2。这种高处理速度是透过避免扩增病毒基因体的需要而实现的,这项新检测使用了针对病毒 RNA 不同部分的 CRISPR RNA 组合,并活化了每个病毒RNA的多个 Cas13a,进而增强了切割报告分子时产生的萤光信号。另外,他们可以使用手机镜头来测量萤光,操作简单且易于携带。
利用 CRISPR 制备疫苗,可行吗?
另一位诺贝奖化学奖新科得主法国微生物学专家 Emmanuelle Charpentier 博士提到,以目前的技术来说,透过 CRISPR 制备COVID-19疫苗,是不可能直接实现的。但是,仍可以透过 CRISPR 去了解病毒怎样复制,间接来帮助研究团队去开发疫苗。
延伸阅读:CRISPR史诗级革新 病毒和肿瘤将无所遁形参考资料:
1. https://eurowire.co/economy/321404/crispr-can-be-a-solution-to-address-the-covid-19-pandemic-roots-analysis/
2. https://sherlock.bio/sherlock-biosciences-receives-fda-emergency-use-authorization-for-crispr-sars-cov-2-rapid-diagnostic/
3. https://www.fda.gov/medical-devices/coronavirus-disease-2019-covid-19-emergency-use-authorizations-medical-devices/vitro-diagnostics-euas
4. https://www.biospace.com/article/crispr-technology-edges-closer-to-commercial-use-/
5. https://doi.org/10.1101/2020.04.20.052159
6. https://blog.addgene.org/sars-cov-2-covid-19-detection-methods-based-on-crispr-cas
7. https://indianexpress.com/article/explained/feluda-coronavirus-covid-19-test-tata-sons-crispr-technology-6603573/
8. https://www.medrxiv.org/content/10.1101/2020.09.28.20201947v1
9. N Engl J Med 2020;383:1492-1494. DOI:10.1056 / NEJMc2026172
10. Nature Biotechnology volume 38, p870–874(2020)
11. Nat Commun 11, 4711 (2020). https://doi.org/10.1038/s41467-020-18575-6
©www.geneonline.news. All rights reserved. 基因线上版权所有 未经授权不得转载。合作请联系:service@geneonlineasia.com





