子宮內膜癌是北美女性中第 4 大最常見的惡性腫瘤,每年估計有 90000 名患者因此死亡。PD-1/PD-L1 抗體為該癌症常見的免疫療法,其中錯配修復缺陷(mismatch repair-deficient, dMMR)已被證明是這類型免疫療法的療效預測生物標記。
FDA 核准子宮內膜癌免疫新藥和其伴隨式診斷上市
近日(4/22),FDA 核准了 GSK PD-1 抗體 JEMPERLI(dostarlimab-gxly)的生物製劑許可證,用於治療錯配修復缺陷(dMMR)復發或晚期子宮內膜癌的成年患者,這是 FDA 核准的第七種免疫療法。
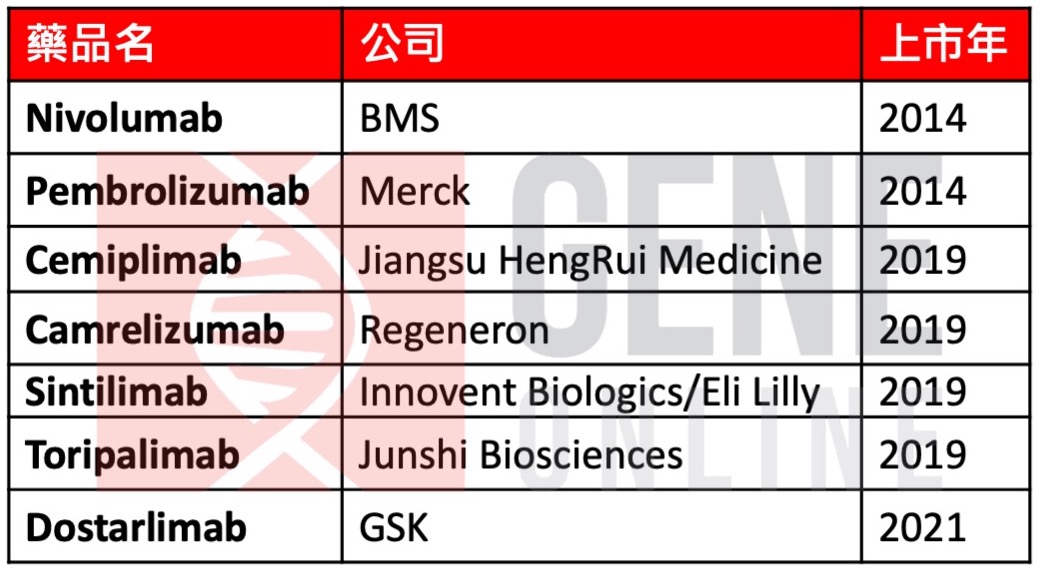
美國 FDA 已核准 PD-1 單株抗體(mAb)
另外,FDA 也於隔日(4/23)核准 dostarlimab 的伴隨式診斷 Ventana MMR Rxdx,該診斷由 Roche 研發。
GSK 將 Jemperli 的定價定為每 500 mg 小瓶 10400 美元,最初是每三週給4劑,然後間隔更長的時間來給予更大的劑量。平均每月批發成本約為 15000 美元,略高於 Keytruda 或 Opdivo 在其他癌症治療的每月成本。
延伸閱讀:PD-1/PD-L1 單抗全球臨床數量倍增 聯合治療成主流臨床試驗 GARNET 驗證 dostarlimab 治療 dMMR 子宮內膜癌的療效
71 名可評估的 dMMR 晚期或復發性子宮內膜癌患者,每 3 週一次接受 500 mg dostarlimab靜脈輸注,共 4 劑,然後每 6 週一次接受1000 mg dostarlimab,直到疾病惡化或出現不可接受的毒性。
結果顯示,客觀反應率(ORR)為 42.3%(95%CI=30.6-54.6)。12.7% 的患者是完全反應,29.6% 的患者是部分反應。其中,在對藥物有反應的患者中,有 93.3% 的患者反應持續時間為 6 個月或更長時間。GSK表示,在追蹤 14.1 個月後,尚未達到反應持續時間中位數(2.6-22.4+)。
另外,在 104 名可評估安全性的患者中,最常見的不良反應是疲勞(48%)、噁心(30%)、腹瀉(26%)、貧血(24%)和便秘(20%)。最常見的 3 級或 4 級不良反應(≥2%)是貧血和轉胺酶升高。其中,5 名患者因副作用嚴重而永久停藥。
Roche 伴隨式診斷
Ventana MMR Rxdx 是一種定性免疫組織化學(IHC)檢測方法,使用光學顯微鏡評估子宮內膜癌組織中的幾種 MMR 蛋白。
2021 年 3 月,FDA 核准了 Ventana ALK(d5F3)伴隨式診斷檢測,可與Pfizer 的Lorbrena(lorlatinib)一起使用,並加入了先前的適應症,以鑑定適合用Pfizer Xalkori 治療的 ALK 陽性非小細胞肺癌患者(crizotinib),Novartis 的 Zykadia(certinib)或 Genentech 的 Alecensa(alectinib)。
延伸閱讀:肺癌治療更精準 羅氏伴隨 Alecensa 診斷試劑 獲得 FDA 核准參考資料:
1. https://www.gsk.com/en-gb/media/press-releases/fda-grants-accelerated-approval-for-gsk-s-jemperli-dostarlimab-gxly-for-women-with-recurrent-or-advanced-dmmr-endometrial-cancer/
2. https://www.biopharmadive.com/news/gsk-jemperli-immunotherapy-fda-approval/598962/
3. https://www.bioworld.com/articles/506320-roche-wins-approval-for-endometrial-cancer-companion-diagnostic
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com