子宫内膜癌是北美女性中第 4 大最常见的恶性肿瘤,每年估计有 90000 名患者因此死亡。PD-1/PD-L1 抗体为该癌症常见的免疫疗法,其中错配修复缺陷(mismatch repair-deficient, dMMR)已被证明是这类型免疫疗法的疗效预测生物标记。
FDA 核准子宫内膜癌免疫新药和其伴随式诊断上市
近日(4/22),FDA 核准了 GSK PD-1 抗体 JEMPERLI(dostarlimab-gxly)的生物制剂许可证,用于治疗错配修复缺陷(dMMR)复发或晚期子宫内膜癌的成年患者,这是 FDA 核准的第七种免疫疗法。
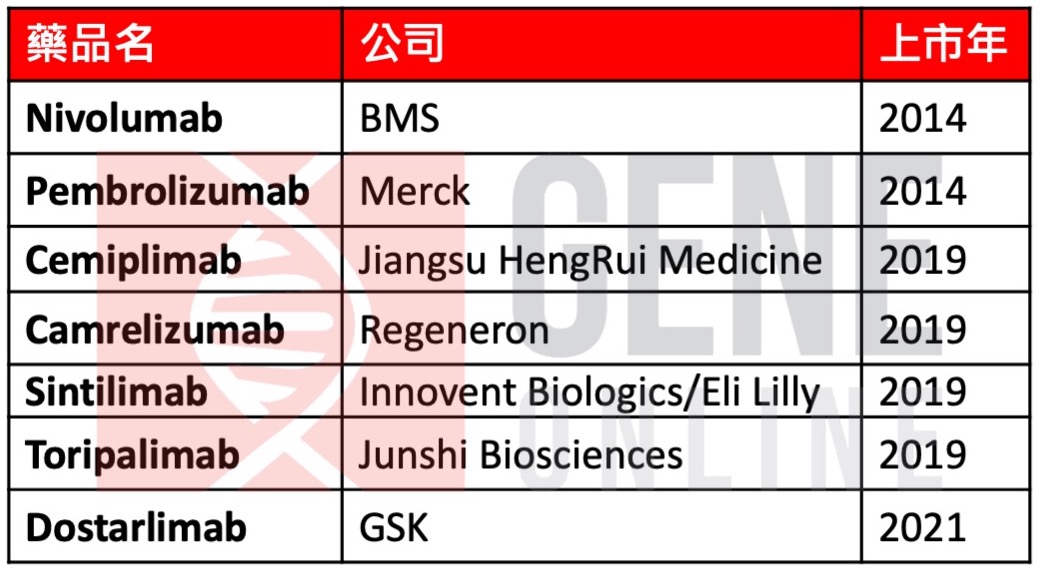
美国 FDA 已核准 PD-1 单株抗体(mAb)
另外,FDA 也于隔日(4/23)核准 dostarlimab 的伴随式诊断 Ventana MMR Rxdx,该诊断由 Roche 研发。
GSK 将 Jemperli 的定价定为每 500 mg 小瓶 10400 美元,最初是每三周给4剂,然后间隔更长的时间来给予更大的剂量。平均每月批发成本约为 15000 美元,略高于 Keytruda 或 Opdivo 在其他癌症治疗的每月成本。
延伸阅读:PD-1/PD-L1 单抗全球临床数量倍增 联合治疗成主流临床试验 GARNET 验证 dostarlimab 治疗 dMMR 子宫内膜癌的疗效
71 名可评估的 dMMR 晚期或复发性子宫内膜癌患者,每 3 周一次接受 500 mg dostarlimab静脉输注,共 4 剂,然后每 6 周一次接受1000 mg dostarlimab,直到疾病恶化或出现不可接受的毒性。
结果显示,客观反应率(ORR)为 42.3%(95%CI=30.6-54.6)。12.7% 的患者是完全反应,29.6% 的患者是部分反应。其中,在对药物有反应的患者中,有 93.3% 的患者反应持续时间为 6 个月或更长时间。GSK表示,在追踪 14.1 个月后,尚未达到反应持续时间中位数(2.6-22.4+)。
另外,在 104 名可评估安全性的患者中,最常见的不良反应是疲劳(48%)、恶心(30%)、腹泻(26%)、贫血(24%)和便秘(20%)。最常见的 3 级或 4 级不良反应(≥2%)是贫血和转胺酶升高。其中,5 名患者因副作用严重而永久停药。
Roche 伴随式诊断
Ventana MMR Rxdx 是一种定性免疫组织化学(IHC)检测方法,使用光学显微镜评估子宫内膜癌组织中的几种 MMR 蛋白。
2021 年 3 月,FDA 核准了 Ventana ALK(d5F3)伴随式诊断检测,可与Pfizer 的Lorbrena(lorlatinib)一起使用,并加入了先前的适应症,以鉴定适合用Pfizer Xalkori 治疗的 ALK 阳性非小细胞肺癌患者(crizotinib),Novartis 的 Zykadia(certinib)或 Genentech 的 Alecensa(alectinib)。
延伸阅读:肺癌治疗更精准 罗氏伴随 Alecensa 诊断试剂 获得 FDA 核准参考资料:
1. https://www.gsk.com/en-gb/media/press-releases/fda-grants-accelerated-approval-for-gsk-s-jemperli-dostarlimab-gxly-for-women-with-recurrent-or-advanced-dmmr-endometrial-cancer/
2. https://www.biopharmadive.com/news/gsk-jemperli-immunotherapy-fda-approval/598962/
3. https://www.bioworld.com/articles/506320-roche-wins-approval-for-endometrial-cancer-companion-diagnostic
©www.geneonline.news. All rights reserved. 基因线上版权所有 未经授权不得转载。合作请联系:service@geneonlineasia.com