1 月 30 日,美國 FDA 宣布核准 Stemline Therapeutics 公司的乳癌新藥 Orserdu(elacestrant),為第一款、也是唯一一款用於帶有 ESR1 基因突變的 ER+, HER2- 晚期或轉移性乳癌病人藥物。Stemline Therapeutics 隸屬義大利第一大藥廠集團 Menarini Group,Menarini 於 2020 年收購該公司便是鎖定其擁有的含蓋乳癌、 多發性骨髓瘤等癌症的多樣產品線。
針對 ESR1 突變的晚期乳癌賀爾蒙治療
晚期乳癌藥物研發可以說是近年國際藥廠的兵家必爭之地,依據不同的基因突變分型確立乳癌診斷與治療指標的趨勢也越加成為主流。回顧去年 FDA 的重大核准案件中,即有針對 HER2 低表達轉移性乳癌的 Enhertu 獲准,其不僅是首支針對 HER2 低表達乳癌族群的標靶治療,更有著重新定義乳癌亞型的指標意義。
據統計美國每年約有 300,000 名乳癌新確診病人,每年超過 43,000 人死於晚期轉移性乳癌。常見 ER+、HER2- 晚期或轉移性族群中約 40% 帶有 ESR1 變異,而 ESR1 變異已知與病人對標準賀爾蒙療法產生抗性有關。Stemline 剛獲核准的 Orserdu 新型荷爾蒙口服藥物,用於至少接受過一線賀爾蒙藥物、帶有 ESR1 (estrogen receptor alpha gene 1)突變的晚期乳癌病人。
晚期乳癌與 ESR1 突變次族群 PFS 顯著改善
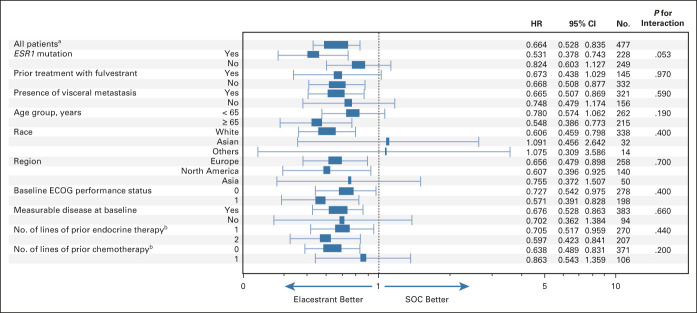
第 3 期 EMERALD 是一項隨機、開放標籤試驗,478 名 ER+, HER2- 晚期或轉移性乳癌受試者都曾接受過 1-2 線賀爾蒙治療,包括 CDK4/6 抑制劑藥物,478 人中約有 47.8% 檢測出帶有 ESR1 突變。受試者以 1:1 隨機分派接受 elacestrant 400 mg 每日口服(n=239),或者單一的賀爾蒙標準治療(standard-of-care, SOC)(n=238),包含 fulvestrant, letrozole, anastrozole, exemestane。
試驗主要評估指標分別為整體受試者、帶有 ESR1 突變次族群的疾病無惡化存活期(progression-free survival, PFS),兩項皆達標。和標準治療組相比,elacestrant 試驗組的 ESR1 突變次族群的疾病惡化或死亡風險降低 45%,兩者中位數 PFS 分別為 1.9 vs. 8.6 個月(SOC vs. elacestrant )。
目前 Stemline 同步進行將 elacestrant 與其他藥物聯用於乳癌試驗,如合併 abemaciclib, onapristone 等。未來該公司也預計將 elacestrant 擴大用於早期乳癌的治療評估。
參考資料:
1. https://www.prnewswire.com/news-releases/stemline-therapeutics-a-subsidiary-of-menarini-group-receives-us-fda-approval-for-orserdutm-elacestrant-as-the-first-and-only-treatment-specifically-indicated-for-patients-with-esr1-mutations-in-er-her2–advanced-or-metast-301733294.htm
2. Journal of Clinical Oncology (2022) https://pubmed.ncbi.nlm.nih.gov/35584336
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com