基因療法是用健康基因取代問題基因的一種現代醫學技術,科學家們希望只需一劑注射來解決過去無法治療的疾病,且數十年來,基因編輯工具的進步也讓該領域突飛猛進,成為不少生技企業奮力角逐的新興市場。
上一篇文章了解過基因療法的緣起與起落後,接下來基因線上 GeneOnline 將解密基因療法的不同載體特色與傳遞機制,讓讀者迅速理解基因療法的面貌。
延伸閱讀:縱覽基因療法演進:充滿希望的序幕、挫敗、如何再起基因療法僅限於編輯體細胞
依照傳遞及作用標的的不同,基因療法可分成生殖細胞(germ cell)基因療法和體細胞(somatic cell)基因療法。前者將基因輸送至卵子、精子等生殖細胞;後者將基因傳遞至骨髓、血液、皮膚細胞等體細胞。目前,所有基因療法皆針對體細胞,這是因為編輯生殖細胞的基因會連同改變下一代人的基因體,而基於倫理道德考量,所以尚未有針對生殖細胞的基因療法出現。
另一方面,體細胞基因療法有 3 類,一是將基因傳遞至患者血液的活體(in vivo)療法,二是在實驗室編輯患者細胞的基因,再輸送回人體的體外(ex vivo)療法,最後則是直接讓基因進入目標器官或組織的原位(in situ)療法。
病毒載體:轉染效率高、可標靶特定細胞
基因療法採用病毒載體與非病毒載體等 2 種方式進行基因轉移(gene transfer)。
病毒載體是使用病毒入侵人體與擴散的特性進行基因轉移,但必須先去除病毒的自我複製機制與致病性,降低患者致病風險,即可作為該療法的載體使用;而病毒的轉導效率就決定了基因轉移的功效。
病毒載體有嵌入型載體(integrating vectors)與非嵌入型載體 2 種,前者如反轉錄病毒(retrovirus)、慢病毒(lentivirus)可以嵌入患者 DNA,後者如腺病毒(adenovirus)、腺相關病毒(adeno-associated virus, AAV)、疱疹單純型病毒(herpes simplex virus, HSV)則會成為游離 DNA(episomal DNA),保留在細胞核中。
而這 2 種載體的差別在於,游離載體不會在患者 DNA 中自行複製,也就是說,載體在細胞分裂後不會存在於子細胞,可在短時間內消失,這對追求轉殖基因短期表現的療法十分有用。
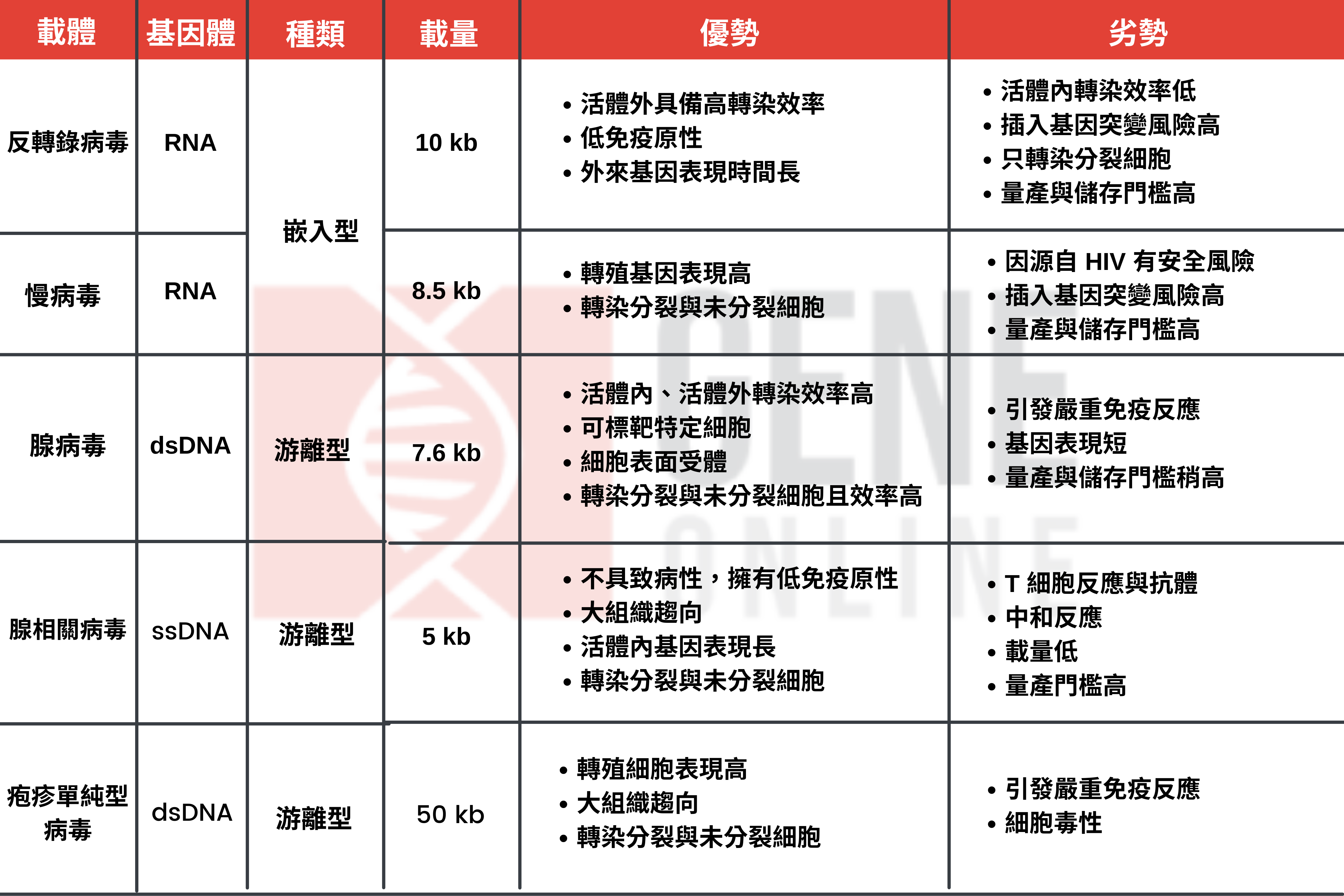
病毒載體中有 DNA 與 RNA 病毒之分。DNA 病毒載體已用於癌症、愛滋病、神經疾病、心血管疾病等多種臨床候選藥物中,舉凡腺病毒、AAV、HSV;而像是慢病毒等 RNA 病毒載體則被用於暫時表現(transient expression)轉殖基因,時下多用於愛滋病治療的臨床試驗。
好用的病毒載體有哪些標準?
判定一個病毒載體是否優秀,可從載量、基因表現時效、組織趨向(能感染的細胞類型和數目)與轉導效率來看。最重要的是,擁有低致病性與免疫原性,才不會在進入人體後引發嚴重的免疫反應。總體來說,AAV 病毒載體是目前主流的基因療法傳遞方式。
美國 FDA 已核准 2 款 AAV 基因療法,分別是 Novartis 治療脊髓性肌肉萎縮症(spinal muscular atrophy)的 Zolgensma(AAV9)與 Spark Therapeutics 治療萊伯氏先天性黑蒙症(leber congenital amaurosis)的 Luxturna(AAV2)。
此外還有多款 AAV 候選基因療法正於第 2/3 期臨床試驗,譬如 Pfizer 治療 A 型血友病的 SB-525(AAV6)、AskBio 治療 B 型血友病的 AskBio 009(AAV8)、Takeda 治療 A 型血友病的 TAK-754(AAV8)、Biogen 治療脈絡膜缺失症(choroideremia)的 timrepigene emparvovec(AAV2)、Homology Medicines 治療苯丙酮尿症(phenylketonuria)的 HMI-102(AAVHSC15)等。
非病毒載體:安全性高、量產門檻低、便宜
製造非病毒載體以裸露質體 DNA(naked plasmid DNA)與微脂體(liposome)為大宗。它們因擁有低免疫原性,比病毒載體更安全,價格上也因量產門檻低,所以更便宜。然而非病毒載體的轉染效率(transfection efficiency)並不高,且難以標靶特定細胞種類,同時也需大數量的載體才有辦法達到治療功效。
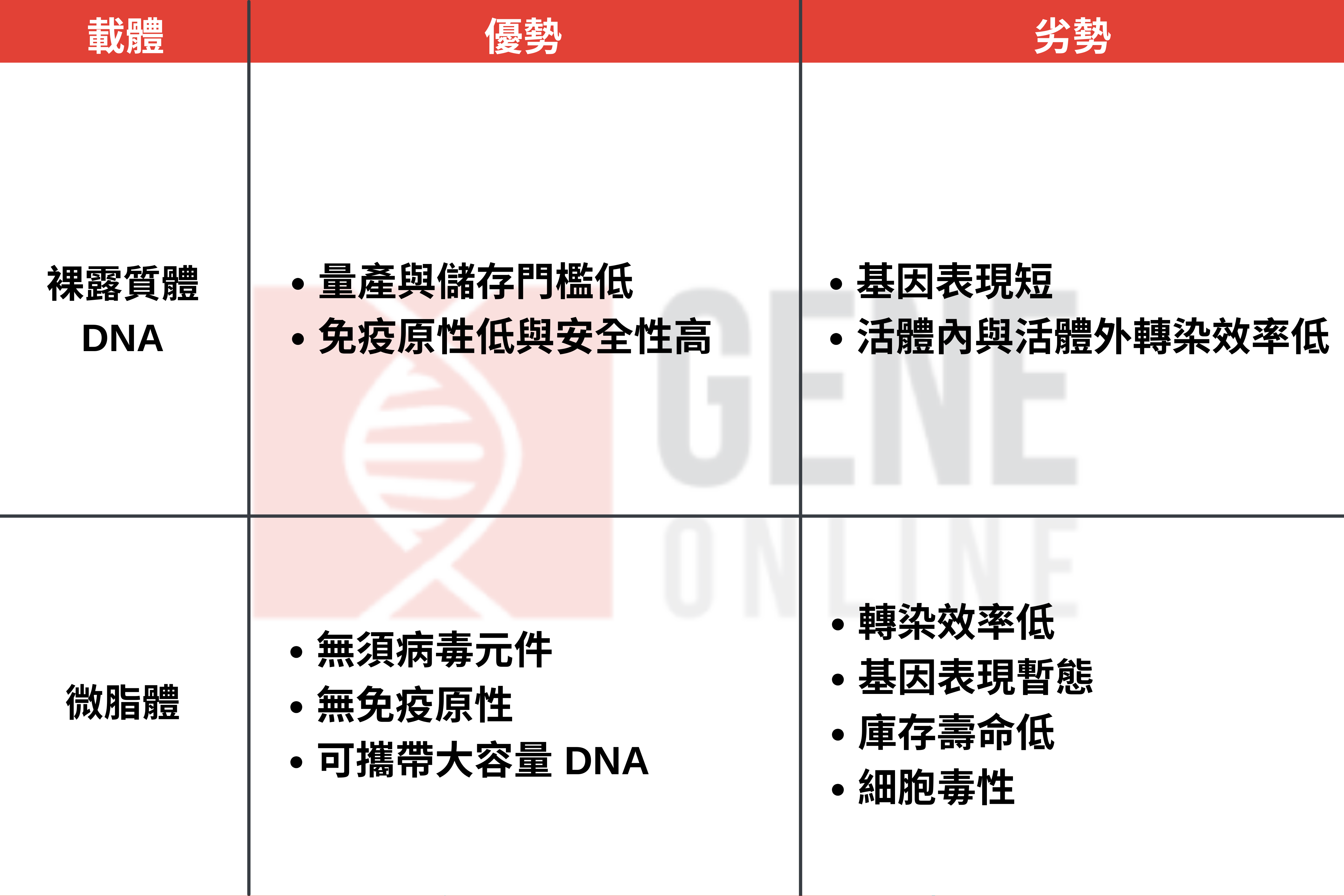
非病毒載體的基因傳遞機制
非病毒載體擁有多種傳遞方式。首先是微量注射(microinjection),這常用於製作基因轉殖小鼠上,但因為質體在核酸內切酶血清(serum endonucleases)中會迅速降解,也容易受胞內體陷套(endosomal entrapment)與腎臟清除作用(renal clearance)破壞,所以微量注射並非傳遞質體 DNA 的最佳方式。
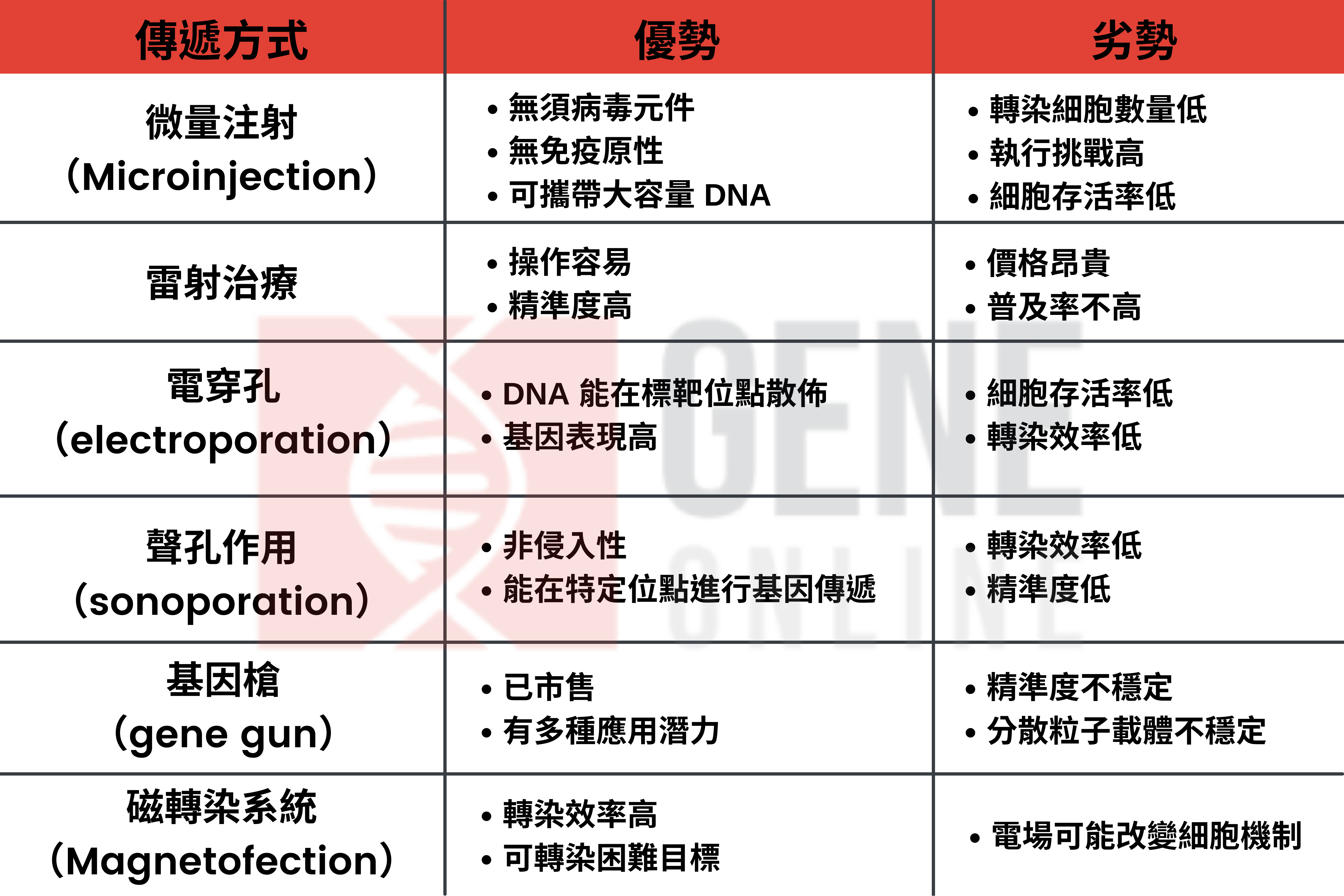
二來是雷射治療、電穿孔(electroporation)與聲孔作用(sonoporation),利用輻射、電場和高密度超聲波,來增加標靶細胞的滲透性與攝取。第三是使用重金屬傳遞裸露 DNA 的基因槍(gene gun),最後是使用電場能量傳遞 DNA 奈米粒子的磁轉染系統(Magnetofection)。
基因編輯工具 CRISPR、ZFN、TALEN 的時代
基因編輯工具 ZFN、TALEN 與 CRISPR/Cas 的出現大幅增加了基因療法的治療範圍,也讓人類可直接編輯人體的基因缺陷。
相較傳統基因療法,CRISPR 不僅治療成本低、精準度高,也擁有相對低的執行門檻,主要由 AAV 載體傳遞。研究人員可把 Cas9 酶和導引 RNA 放入 DNA 質體載體,再裝入 AAV 即可使用;但 AAV 載體由於載量較低,所以仍有技術挑戰要解決。
CRISPR 基因療法還可將導引 RNA 放入能表現 Cas9 的細胞中進行傳遞,另外也有將 Cas9 的 N- 端與 C- 端放入 2 個 AAV 載體,並在轉染細胞時組合成可正常運作的 Cas9 進行治療。目前 CRISPR 基因療法的最新傳遞方式是使用金黃色葡萄球菌(Staphylococcus aureus)的小型 Cas9,這種方式較不佔據 AAV 載體的空間。
CRISPR 常用於活體外基因療法,舉凡 CRISPR Therapeutics 與 Vertex Pharmaceuticals 透過編輯造血幹細胞,共同開發的 β-地中海型貧血症與鐮刀型紅血球疾病(SCD)的 CRISPR 基因療法 CTX001。
另一方面,CRISPR 在治療杜氏肌肉萎縮症(Duchenne muscular dystrophy, DMD)與遺傳性高酪胺酸血症(hereditary tyrosinemia)上會採用靜脈或針對特定組織注射的活體內治療方式,例如史上第 1 個直接注射於人體的基因療法,由 Editas Medicine 開發治療萊伯氏先天性黑蒙症的 EDIT-101 就是一例。
基因療法前景可期
儘管基因療法在製造、安全性、功效上仍有挑戰,但仍是遺傳性單基因疾病與複雜重症的潛力解方。而時下全球基因療法領域中,可見源源不絕的創新與資本投入,這些將成為基因療法技術突破與克服應用挑戰的良好基礎,更有望在未來造福更多患者。
作者:Rajaneesh K. Gopinath
編譯:Tyler

參考資料:
1. https://geneonline.news/en/a-brief-sketch-of-gene-therapy-vectors-and-delivery-methods/
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com





