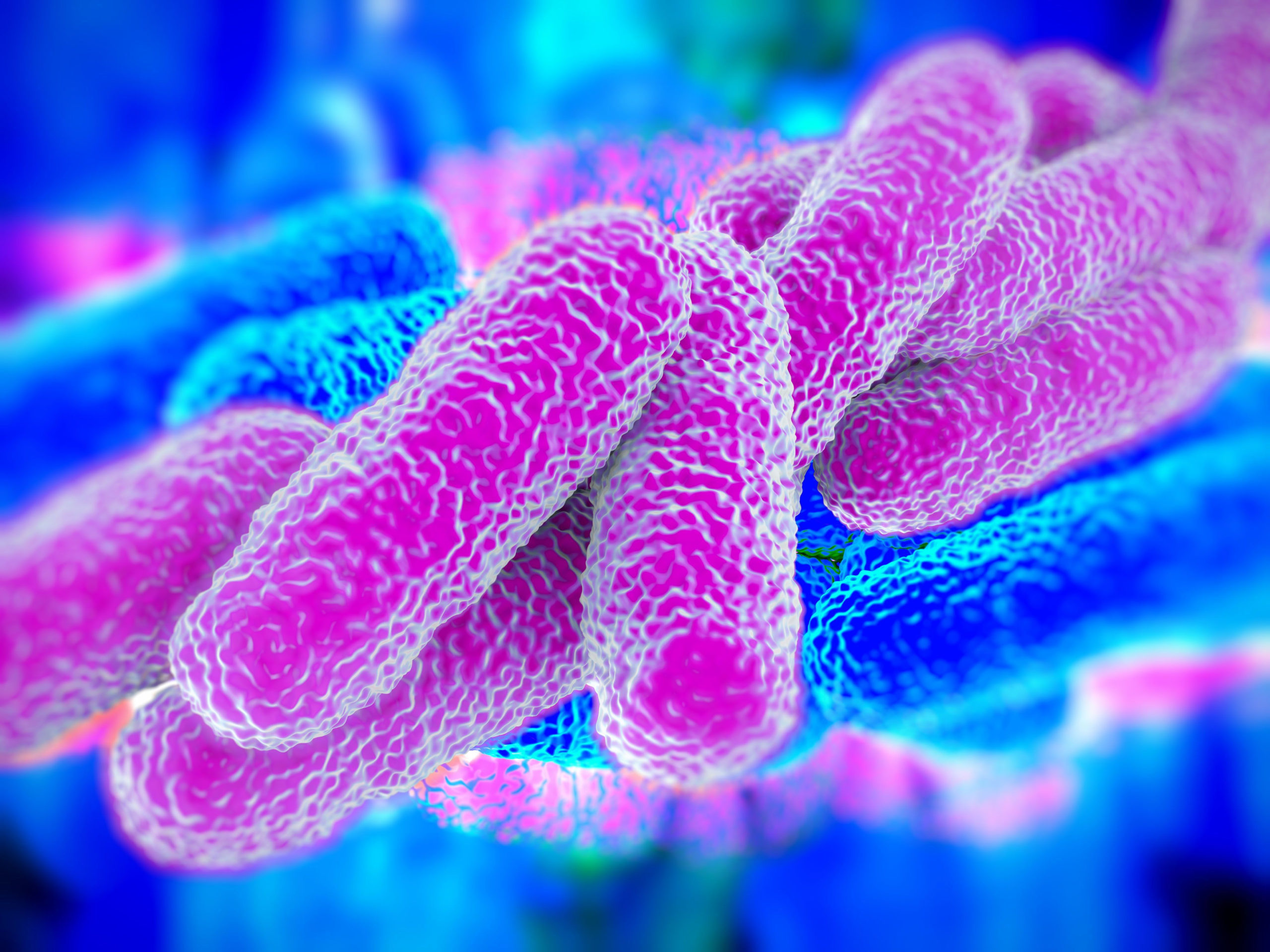
革兰氏阴性菌(gram-negative)是容易产生多重抗药性的细菌类别,它们会在细菌外层建立起一道能阻挡宿主免疫系统、抗生素攻击的防护膜,当有抗药性基因型的细菌快速传播造成病患用药选项受限,引发相关病症包括肺炎、血液感染、以及手术部位感染等。
过去已知革兰氏阴性细菌外膜为脂多糖(lipopolysaccharide)防护构造,由脂质和糖类组成,但既有研究不清楚脂质与糖类是如何结合的。
美国哥伦比亚大学(Columbia University)最新发布在《Nature》期刊中指出,已发现了负责连结脂质与糖类的跨膜酵素 O-antigen ligase,未来只要透过阻止脂多糖组装机制,就能开发出抑制防护膜生成、缓解细菌抗药性的药物。
微生物将开创医美产品新未来?(基因线上国际版)发现催化脂多糖合成的关键酵素
为了在观察细菌脂多糖在原子层级上构造,研究团队采用冷冻电子显微技术分析,提出催化脂多糖合成的 O-antigen ligase 两种不同构型。在得知其构造后,他们进一步结合遗传、生化分析,了解到 O-antigen ligase 如何定位脂质与糖类,以及如何结合两者。
此种酵素催化脂多糖的最后步骤,是由 O-antigen ligase WaaL2 催化完成,WaaL2 ligase 主要分布于重金属土壤细菌 Cupriavidus metallidurans。团队发现 WaaL2 有 12 个穿膜螺旋结构,并且其在革兰氏阴性菌细胞膜与外膜之间主要分布 α-螺旋结构,α-螺旋中有许多保守序列蛋白,例如 构成 GT-C 型糖基转移酶(glycosyltransferase),是催化脂多糖合成的重要构造。
可设计抑制脂多糖合成的药物
本研究指出细菌生成抗药性构造的最后关键步骤酵素,将来可透过抑制此机制设计脂多糖外膜合成的药物,以减轻多重抗药性与重复感染的疾病困境。
此外,研究也发现革兰氏阴性菌合成脂多糖外膜的过程为持续降解、修复的建构方式,这意味着在细菌生命周期里有相当多机会可以破坏外膜合成,提升了药物介入的可行性。
延伸阅读:细菌抗药机制有望破解?药物运输蛋白的结构转换是关键参考资料:
- https://www.cuimc.columbia.edu/news/study-unlocks-key-success-drug-resistant-bacteria
- Nature, 2022; https://www.nature.com/articles/s41586-022-04555-x
©www.geneonline.news. All rights reserved. 基因线上版权所有 未经授权不得转载。合作请联系:service@geneonlineasia.com