T 細胞細胞膜表面上有免疫檢查點 PD-1,腫瘤細胞會分泌其配體 PD-L1 與 PD-1 結合時,能抑制 T 細胞介導的腫瘤毒殺反應,此時,腫瘤細胞逃避免疫系統的監視,避免免疫細胞的追殺。為了阻止腫瘤細胞的詭計,PD-1/PD-L1 抑制劑(單株抗體)已成為近年來最火熱的癌症免疫治療藥物之一。
全球 PD-1/PD-L1 抑製劑市場總值在 2018 年為 201.4 億美元,預計到 2026 年將達到 774.4 億美元,複合年增長率為 18.24%。今年有 4 種新的 PD-1 單株抗體(mAb)進入市場,使全球市場上市總數達到 9 種(圖一)。
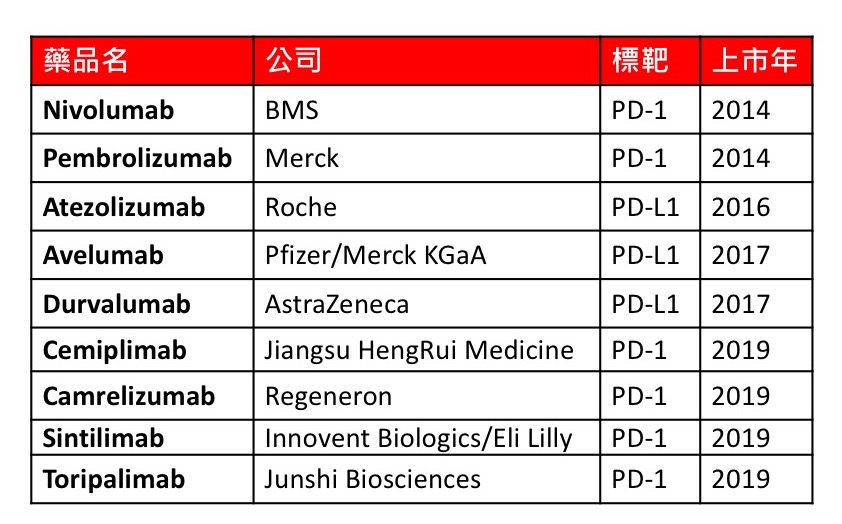
表一、全球市場已核准上市 PD-1/PD-L1 抑製劑
另外,FDA 已核准 14 種聯合療法,顯現出從單一療法療法轉變為聯合療法的趨勢。
臨床試驗倍增 聯合治療成主要趨勢
自 2006 年以來,已啟動 3362 個臨床試驗來單獨或合併其他藥物測試 PD-1/PD-L1 單株抗體,截至 2019 年 09月,仍有 2975 個臨床試驗仍在進行中,計劃招募 500000 多名患者。與在 2017 年 9 月進行的首次調查相比,多出 1469 項臨床試驗,其中 76% 涵蓋大多數癌症類型的治療方案,如PD-1/PD-L1 單株抗體合併其他免疫腫瘤療法或標靶療法、化療或放射療法。
在過去 2 年中,三種最常見的 PD-1/PD-L1 單株抗體聯合療法是合併化療(235項新試驗)、CTLA-4 單株抗體(186項新試驗)和標靶血管內皮生長因子(VEGF)軸的療法(114項新試驗)。
患者招募率 中國一馬當先
根據 IQVIA 已完成和正在進行的 PD-1/PD-L1 臨床試驗真實數據指出,中國每個單藥治療臨床試驗的患者招募中位數是美國的 6 倍,聯合治療則是美國的 4 倍。隨著 PD-1/L1 臨床試驗向亞洲擴展,新興市場中的大量合格且先前未接受治療的患者可以從中受益。可能原因是,中國每年有超過 400 萬新發生的癌症病例,其中大多數中國癌症患者未接受 PD-1/PD-L1 單株抗體。
然而,與其他獲批准的PD-1/PD-L1單株抗體相比,中國生技藥廠在中國生產的三種 PD-1 單抗(sintilimab、toripalimab 和 camrelizumab)的臨床開發迅速(26-45 個月),它是透過輔助這些臨床試驗的快速招募患者。由於中國最近加入了國際人用藥品技術要求統一委員會(ICH),因此在中國進行的試驗產生的數據可能會支持其他 ICH 成員國的市場應用。全球 PD-1/PD-L1 試驗群體可利用這一寶貴的患者資源來加速其臨床開發。
隨著 PD-1 / PD-L1 單株抗體轉向聯合療法,未來需要針對每種聯合策略開發有效的生物標記,以監測和鑑定癌症病人的反應。此外,由於大多數接受批准的PD-1/PD-L1 單株抗體方案治療的患者會產生耐藥性或複發。因此,該領域應更加聚焦於開發針對 PD-1/PD-L1 耐藥性的新型組合。這些新穎的生物標記和療法需要在臨床試驗中進行測試,這些試驗需要豐富患者的亞群。
延伸閱讀:癌細胞胞外體分泌PD-L1 遠端抑制淋巴結內免疫細胞參考資料:
1. https://www.verifiedmarketresearch.com/product/pd-1-and-pd-l1-inhibitors-market/
2. https://www.nature.com/articles/d41573-019-00182-w
3. https://www.cancerresearch.org/scientists/immuno-oncology-landscape/pd-1-pd-l1-landscape
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com