相較於雙股螺旋 DNA,RNA 研究發展和新藥開發的相關知識、技術則前進得較為緩慢。科學家於 1960 年代發現 mRNA)的存在,但是 RNA 編輯技術的應用一直到 1990 年代開始起步,直至最近 20 年間,RNA 相關的疫苗研發、新藥開發、核准與上市才蓬勃發展。
儘管 DNA 編輯技術發展較成熟,但 DNA 編輯發生後就無法回復,是技術發展的一大限制。相較之下 RNA 編輯較具有可以修復的彈性,產生的不良反應也比較少。本期基因線上 GeneOnline 專題聚焦這項具有潛力的基因編輯技術,分別回顧 RNA 編輯技術發展歷程、產業動態、專家訪談 3 大面向,深度介紹 RNA 編輯的發展進程。
延伸閱讀:自然 RNA 修飾,基因檢測的新興潛力股!專訪中研院莊樹諄研究員話說從頭:RNA 編輯的起源
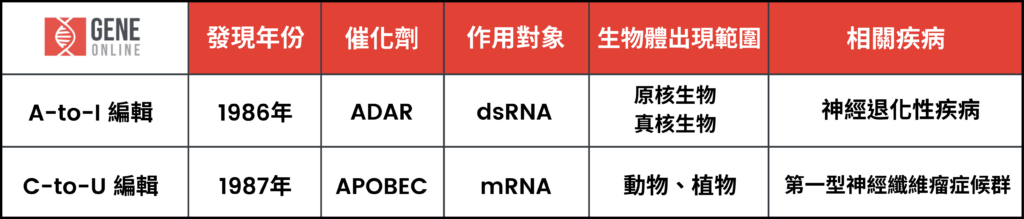
RNA 編輯的起源,可以回溯到 1986 年單細胞原蟲體內觀察到的現象。Rob Benne 和幾位科學家發表於《Cell》研究發現,原蟲粒線體中轉移突變的細胞色素氧化酶基因轉錄本,帶有 4 個非由 DNA 編碼來的外插尿嘧啶(Uracil)序列。他們於是把尿嘧啶的插入現象,也就是 RNA 在轉錄後修飾,使其與 DNA 序列不相應的機制,命名為「RNA 編輯」。
隔年,L. M. Powell 與另一批科學家很快就在哺乳類體內也發現類似的現象,甚至更為驚人:當 RNA 編輯將特定序列修飾為終止密碼子(stop codon),RNA 小變動便會使其轉譯出截然不同的蛋白質。
自此,RNA 編輯被用於泛指 RNA 轉錄後的修飾機制,一般而言可依其運作方式分為兩大類。第 1 類指 RNA 插入/刪除(insertion/deletion)現象,此類編輯機制發生在轉錄形成成熟 RNA 以前,會更動基因組長度。第 2 類編輯機制則不會改變 RNA 總長,而是藉由更動核酸的鹼基對影響其後續作用。以上 2 類修飾都會與原始 RNA 模板產生不同的轉譯結果,也間接提高了生物的遺傳多樣性。
RNA 編輯機制一覽:A-to-I、C-to-U 及其他
至於 RNA 編輯涵蓋哪些機制,以下分別從 A-to-I、C-to-U 和其他兩種衍伸類型,介紹 RNA 編輯的技術核心。
1. Adenosine to inosine(A-to-I)編輯
A-to-I RNA 編輯是由 ADAR 催化發生的反應。ADAR 辨識並解開雙股 RNA 後,將腺苷(A)置換成肌苷(I),是生物體最主要出現的 RNA 編輯形式。
A-to-I 編輯是人體中最常見的 RNA 編輯機制,人體內這種基因編輯機制的作用目標是 Alu 元件(Alu element)。Alu 元件是一段特殊基因片段,它在人類基因體中高度重複出現,佔據 11% 的基因片段,且人體全部 Alu 元件中至少包含 1 億個 A-to-I 編輯位點,如果這些片段的 RNA 編輯功能異常會造成神經退化性疾病。
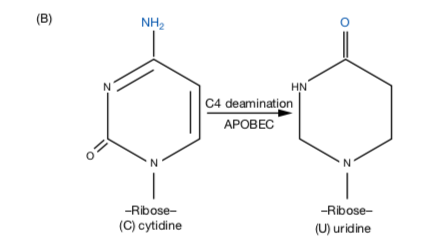
2. Cytidine to uridine(C-to-U)編輯
C-to-U RNA 編輯發生於單股 mRNA ,催化 C-to-U 編輯的酵素是 APOBEC,APOBEC 不僅執行 RNA 編輯,也會催化特定形式的 DNA 編輯。
最早在生物體內被發現的 C-to-U 編輯案例,與小腸載脂蛋白 apo-B48 和肝載脂蛋白 apo-B100 有關。這兩種蛋白質分別在小腸與肝臟作用,但回溯到上游基因轉錄過程,兩種蛋白源自相同的 DNA 序列,是因為轉錄過程的基因模板發生 C-to-U 編輯作用,才造成轉譯出兩種完全不同的蛋白質。C-to-U 相較於 A-to-I 編輯在生物體內相當少見,但若功能異常,仍會導致嚴重疾病。
3. 應用 CRISPR-Cas 的 RNA 編輯技術(Cas-based ADAR)
Cas-ADAR 是一種結合 DNA 編輯與 RNA 編輯的技術,它的原理是透過執行 DNA 編輯的 Cas9 蛋白,和單股導引 RNA(sgRNA)結合,再去編輯目標 mRNA。這項技術的好處是既能表現 DNA 編輯的高編輯效率,也能顧及 RNA 編輯低脫靶效應(off-target)的優點。
Cas-ADAR 與目標 RNA 的結合力相當高,近幾年有研究便透過以 RNA 為標的的 Cas9(RCas9)技術,修復小鼠體內導致肌肉強直症(myotonic dystrophy)基因。
4. PPR 編輯技術
Pentatricopeptide repeat (PPR)蛋白廣泛存在植物體內,它會結合植物粒線體或葉綠體的基因轉錄本,修飾其 RNA 序列進而影響植物的光合作用、呼吸作用等功能,這類蛋白的潛力也被應用至 RNA 編輯技術領域。
在人類現有疾病中,約有 15% 和 RNA 編輯異常功能有關,非編碼 RNA 的基因活性失調更是許多疾病的起因,PPR 正好能在其精準編輯的特性上補足臨床應用的需要。
已有研究在人類與小鼠模型中透過 PPR 蛋白修飾與眼部和神經疾病相關的 RNA,將來可能作為老年性黃斑部病變的治療方式。此外改良的 PPR 編輯技術也可引導 RNA 轉錄本在細胞內定位,以提升讀取 RNA 轉錄本產出蛋白質的效率。
各有千秋:RNA 編輯 vs. CRISPR
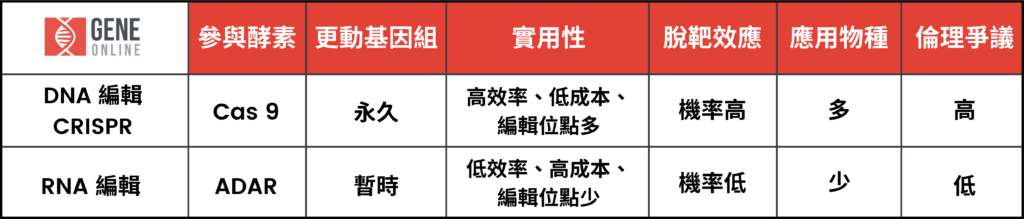
回到基因編輯的技術發展史,不能不提到 DNA 編輯的霸主 CRISPR。簡單而言,它的原理是透過人工改造形成的單股導引 RNA 與 Cas9 蛋白作用後,在 DNA 序列上執行定點切割。
CRISPR 最大技術問題便在於,對基因組造成永久的更動,所造成後續效應不論在生物體本身或者倫理層面都引發相當爭議。
相較之下,儘管 RNA 編輯技術成本較高,編輯效率不如 CRISPR 高與應用廣泛,但 RNA 編輯仍是基因編輯界可矚目的新星。其轉錄後修飾機制並不會對基因組造成永久性的更動、產生脫靶機率較低、適合在體外進行、再加上參與蛋白 ADAR 是人體本身就帶有的酵素,不容易引發免疫系統激烈反應,都是 RNA 編輯應用上明顯具有的安全優勢。下一篇將延續從 RNA 編輯的產業概況,進一步介紹 RNA 編輯的市場應用趨勢。
參考資料:
1. Cell, 1986; https://pubmed.ncbi.nlm.nih.gov/3019552/
2. Cell, 1987; https://pubmed.ncbi.nlm.nih.gov/3621347/
3. Journal of Translational Medicine, 2019; https://translational-medicine.biomedcentral.com/articles/10.1186/s12967-019-2071-4
4. Reference Module in Biomedical Sciences, 2019; https://www.sciencedirect.com/science/article/pii/B9780128012383113649
5. Cells Reports, 2020; https://www.sciencedirect.com/science/article/pii/S2211124720313395
6. https://www.nature.com/articles/d42473-019-00327-w
7. https://www.nature.com/articles/d41586-020-00272-5
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com