多年来,生物制药市场一直以针对细胞蛋白质的小分子药物为主。然而,大多数还是无法成功开发进入市场。在近几十年中,RNA领域的突破性研究推动RNA疗法的发展。尽管RNA本身的特性使得在药物开发过程中多了不少挑战,但与现有疗法相比,它仍具有某些优势。且让我们一同回顾 RNA 领域近年来发展及未来展望。
化学药物治疗一直以来都是人类在对抗重大疾病的重要武器。尽管如此,仍然存在一些疾病是尚未找到候选药物或是无法完全治愈。即使收集了大量关于致病机转的资料,许多疾病现阶段仍然被评为“无药可医”。目前市面上大多数美国FDA批准的药物都是属于作用于蛋白质(例如酶、激素或受体)的小分子抑制剂,而这仅包含一小部分的细胞蛋白。蛋白药物(例如抗体)虽然表现出绝佳的特异性,但是却具有其他重大挑战,例如分子量庞大和及稳定性不佳。病患个体DNA的差异性大以及抗药性问题进一步加剧了这些挑战。综观以上问题,对新型生物制剂的需求是从不间断的。
RNA疗法的优势与劣势
近几年对于RNA领域的研究有了开创性的发现,如干扰性RNA以及发现非编码的RNA。这些研究都进一步促进了运用此大分子来开发新疗法。尽管在过去的20年中已经研究了多种RNA治疗模式,但迄今为止FDA仅批准了7个药物(图1)。
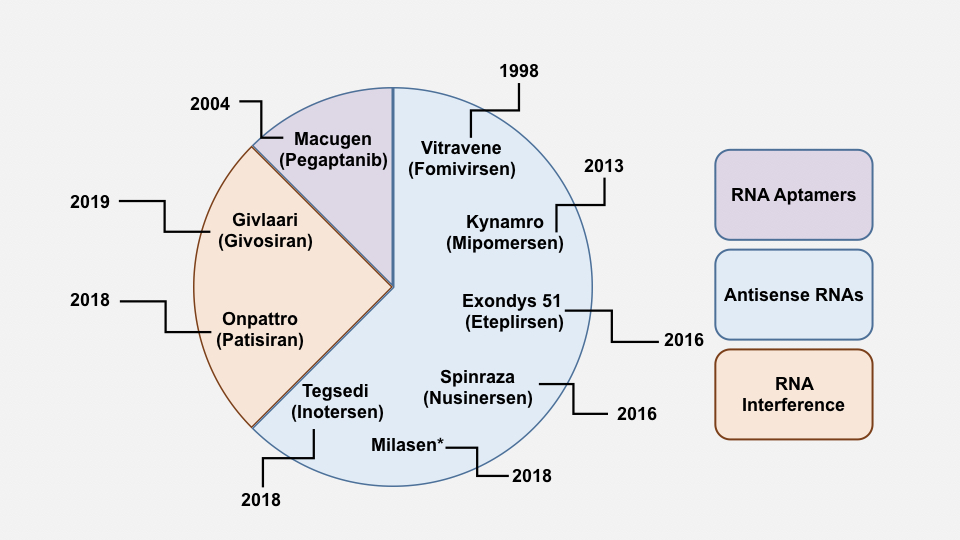
图1:近年来,FDA批准的RNA疗法。 *米拉森(Milasen)是特例,已获得批准,其中仅用于1位患者。
部分 RNA 药物优于小分子药物的特点在于它们可以直接与 mRNA 结合并造成其降解,从而防止致病蛋白质被转录。另一个优势是RNA药物可以轻易地将其与现有疗法合并使用。然而它们并不稳定,容易被核糖核酸酶降解以及免疫原性不佳是主要障碍。另一个艰钜的任务是找到合适的标的细胞并设计适当的投药路径使药物可以顺利通过双层脂质的细胞膜。以上挑战若能被克服,与传统药物相比,之后开发路程会相对容易许多。
近年来,CRISPR/Cas9 技术的进展突飞猛进,将 RNA 药物开发提升到了一个新的境界。现在可以借由诱导染色体突变来改变病患基因的表达。CRISPR/Cas9 技术才刚刚开始涉足 RNA 编辑,而能做到的事情远远超出超出了过往的进展。让我们看一下过去几十年来其他一些RNA药物的开发历程(图2)。
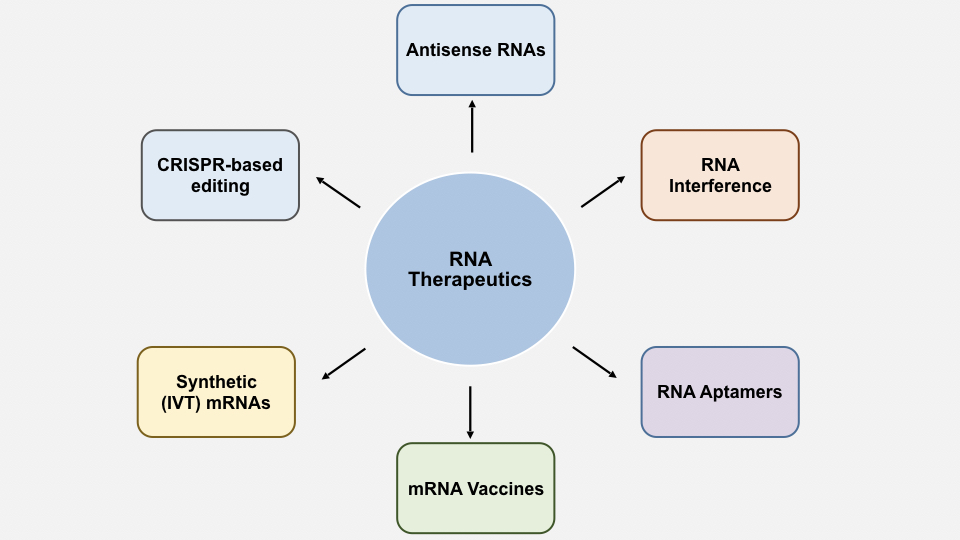
图2:目前以上市的不同类别RNA药物
反义RNA药物
反义寡核苷酸(antisense oligonucleotide, ASO)的药物原理是与靶标mRNA互补碱基配对,也因此成为有吸引力的待开发潜力治疗选择。这个想法源自于1978年,当时设计了一种特定的寡脱氧核糖核苷酸(oligodeoxyribonucleotide)用来抑制肉瘤病毒(Rous sarcoma virus)的RNA转译。为了解决核糖核酸酶(ribonucleases)等诸多影响,ASO经过许多化学修饰。在碱基、糖基、核苷间链结的修饰或大、小大分子偶联等使用皆明显改善了药代动力学、稳定性、结合亲和力以及效力。一些常见的修饰包括2′-O-甲基,2′-氟,5-甲基胞嘧啶和2′-O-甲氧基乙基等取代基。
Ionis Pharmaceuticals独领风骚
2016年,Exondys 51 和 Spinraza 两个 ASO 药物获得FDA的批准,为市场首开先路。Sarepta Therapeutics 开发的Exondys 51(Eteplirsen)可用于治疗因肌缩蛋白(dystrophin)基因突变所造成的裘馨氏肌肉失养症(Duchenne Muscular Dystrophy, DMD)并获得快速审查。此ASO含有二氨基磷酸酯吗啉基修饰(phosphorodiamidate morpholino modification),可以透过在pre-mRNA splicing时驱动exon 51的切除,修正下游肌缩蛋白的读取区以治疗疾病。同样的,Spinraza(Nusinersen)也改变了RNA剪切(RNA splicing),来治疗由SMN1基因变异或同型合子缺失所引起的脊髓性肌萎缩症(Spinal Muscular Atrophy, SMA)。它具有两个修饰:2′-O-甲氧基乙基取代(2’-O-methoxyethyl substitution)和硫代磷酸盐键结(phosphorothioate linkage)进而降低亲水性、增加稳定性并增强蛋白质结合能力,这些条件对于细胞摄取和细胞内的分布至关重要。该药物最初由马萨诸塞大学医学院 (UMass Medical School) 的 Dr. Ravindra Singh团队所发现,授权给 Ionis Pharmaceuticals(以前称Isis Pharmaceuticals)与冷泉港实验室的 Adrian Krainer 教授合作开发药物化合物。与Biogen的商业合作让后者获得了Spinraza开发和商业化的拥有权。
Ionis Pharmaceutical 的 Tegsedi(Inotersen)去年获得FDA的批准,用于治疗遗传性甲状腺素调控的类淀粉变性(hereditary transthyretin-mediated amyloidosis, hATTR)引起的多发性神经病变(polyneuropathy)。此ASO药物具有许多修饰包含:2′-O-甲氧基乙基,5-甲基尿嘧啶,5-甲基胞嘧啶,钠盐和硫代磷酸盐键。去年,Ionis及其子公司 Akcea Therapeutics 的另一个 ASO 药物─Waylivra(Volanesorsen)因安全性考量上在FDA踢到了铁板。然而,今年5月却获得了欧盟的批准,用于治疗家族性乳糜微粒血症(Familial Chylomicronemia Syndrome, FCS)的成年患者。显著的临床试验数据和欧盟的批准让其决定再次尝试申请美国的授权。时至今日,Ionis具有75.7亿美元的市值,多元化的产品线使其在临床试验的各个阶段都拥有各类型顶尖的药物,可治疗多种疾病,包括癌症,心血管疾病,神经疾病,感染性疾病和肺部疾病。
ASO药物与个人化医疗
去年有个特例,一个ASO药物─Milasen迅速被开发且通过FDA批准,进而救了一名患者成为个人化医疗的开创性典范。波士顿儿童医院的 Dr. Timothy Yu和他的同事借镜Spinraza,设计了一种寡核苷酸,用于治疗一位患有巴登氏病 (Batten disease) 的6岁儿童Mila Makovec,巴登氏病是罕见的致命神经退行性疾病。随后掀起一场为Mila开发药物的竞赛 : 比赛在药物开发上创纪录。
RNA干扰药物
细胞中RNA干扰机制是借由小的非编码RNA(例如siRNA和miRNA)经由转录或转录后静默基因来控制基因的表达。内源性的miRNA透过有限的互补碱基配对来识别并结合目标mRNA,进而使其裂解或抑制转译;siRNA则是由外源dsRNA制成,并可完美的与mRNA互补结合。这两类RNA都需要宿主的内源机制来生产制造。在线虫研究中的重大发现一口气将RNA的研究推至新的境界,而其作为改变基因表达的功能则持续对其他各个领域造成影响。同时,药物开发人员开启了对RNAi的兴趣,现在亦有许多siRNA药物进入了临床试验阶段。与ASO一样,RNAi药物需要修饰以增强效力并且避免过多非特异性结合。Alnylam Therapeutics 是一家知名的RNAi药物开发公司,成立于2002年,目前市值为99.2亿美元。Onpattro(Patisiran)是历史上第一个被FDA批准的RNAi药物。Patisiran目前用于治疗遗传性甲状腺素转运蛋白淀粉样变性(hATTR)。11月20日,该公司宣布FDA批准了针对氨基乙酰丙酸合酶1(ALAS1)的 Givlaari(Givosiran),用于治疗急性肝性紫质症(AHP)。
Dicerna Therapeutics 是一家规模较小的 RNAi 药物开发公司,但仍被誉为紧追 Alnylam 以及 Ionis 之后极具潜力的团队。它已经发明了一种名为 GalXCTM 的新技术,推动下一代 RNAi 治疗的开发。以 GalXC 技术为核心的药物是借由 Dicer 酶来作用,该酶所引发的 RNA 干扰机制可以静默引起肝脏疾病的基因的表现。该公司在临床前和临床试验中有许多候选药物,但其最先进的是治疗原发性高草酸尿症的 DCR-PHX,这是一种罕见肾脏疾病,肾脏无法正常发挥功能来过滤掉体内废物。
延伸阅读:英 NHS 于 JP Morgan 宣布携手 Novartis 开发 RNAi 降血脂针剂同样地,许多 miRNA 拟似物的治疗方法正在临床前开发或早期临床试验中。这些药物模拟内源性的 miRNA 来结合其靶标以诱导基因静默。普遍上认知内源性 miRNA 的缺失是会导致肿瘤的增殖和发展。于 2017 年,一份研究文献介绍了 MesomiR-1,这是第一个进入人体临床一期试验的载有微小 RNA 的微小细胞(EnGeneIC Dream Vectors),被称为 TargomiRs。它们是基于 miR-16 的 miRNA 模仿物,以 EGFR 为标靶用于恶性胸膜间皮瘤的临床前治疗模式中。这种新颖的治疗方法将如何发展还有待观察。 Miragen,MiRNA Therapeutics(现为Synlogic)和 Regulus Therapeutics 是一些专门开发 miRNA 药物的公司。尽管他们中没有发展到3期临床试验的药物,但已经有许多药物于2期临床试验进行中。
RNA适体(RNA aptamers)
与上述类别不同,RNA 适体是直接作用并阻断蛋白质产物。它可以通过多次体外或细胞层级的筛选过程所筛出,该过程技术称为SELEX(systematic evolution of ligands by exponential enrichment)。透过SELEX的过程,可以从RNA库中挑选出许多独特的序列来结合蛋白质标的。它们的功能类似于抗体但更容易制造,而小体积的优势,可与标的蛋白质难以接触的结合位点相互作用,除此之外更具备较稳定的结构、高耐热性,并且像其他 RNAi 治剂一样,可以通过化学方法进行修饰。Macugen(Pegaptanib)是首个获得FDA批准的适体药物,用于治疗新生血管型老年性黄斑部病变(neovascular age-related macular degeneration, AMD)。但它最初的设计是作为治疗癌症的anti-VEGF适体。同样的,许多针对EGFR、HER2、HER3、PD-1/PD-L1、CD-40或核仁素(nucleolin)的适体,已被开发并在临床试验中证明其具有抗肿瘤特性。目前,补体C5抑制剂Zimura(avacincaptad pegol)正在临床试验阶段,试验与 Lucentis 联合治疗AMD。
mRNA治疗:合成(IVT)mRNA和疫苗
体外转录(In vitro-transcribed, IVT)的合成 mRNA 是一类新兴的RNA治疗药物,其中导入细胞的mRNA分子可以产生出具有功能的蛋白质。早在1990年代,Wolf等人就已经证明了宿主细胞的蛋白质合成机制可以转录体外合成的 mRNA 以生成新的蛋白质。它可以是抗体、蛋白抗原、细胞激素或基因编辑蛋白。但仅在优化mRNA稳定性和转译效率后,这个概念才受到关注。就像内源性mRNA一样,体外合成的mRNA模板必须包含优化的结构,例如5’cap、5’UTR、编码序列、3’UTR和polyA尾端,以提高功效并防止不乐见的免疫原性反应。然而,它们的免疫原性是有利体外合成mRNA被开发为疫苗的一项特性。与传统疫苗相比,mRNA具有强效且稳定持久的品质。此外,它们可大量生产且容易引发类似于病毒感染的免疫反应是非常大的优势。目前,许多mRNA疫苗正在进行人体临床试验,mRNA治疗剂和疫苗开发的先驱—Moderna Therapeutics 目前也已经有不少药物正在开发阶段。 今年9月,它宣布与哈佛大学长期合作,即将在哈佛医学院建立调节免疫系统的RNA治疗联盟(ARTiMIS),该联盟将利用mRNA平台和奈米颗粒递送技术增进免疫学领域的研究。
RNAi治疗的未来与挑战
除了不良的药物动力学、稳定性和非特异性结合外,某些RNA药物(尤其是ASO和siRNA疗法)的主要缺点是细胞吸收率差。RNA药物必须通过脂双层,透过胞吞作用进入细胞。并且经过核内体逃脱(endosomal escape)才能到达细胞质。RNA必须用阳离子脂质或其他类型的奈米粒子进行转染,在物理层面才能保护RNA免于被降解,并促进细胞吸收和核内体逃脱。然而这种方法并不保证安全,因为脂质奈米粒子会引起肝脏毒性。另一方法是将RNA与目标配体结合,比如N-乙酰半乳糖胺(GalNAc)。GalNAc是一种氨基糖,由于其受体在肝细胞表面高度表达,有助于将RNA有效地靶向肝脏细胞。RNA治疗的新领域正稳健发展,尽管目前为止只批准了少数几种RNA药物,但仍鼓舞了其余尚在临床试验阶段的药物。可以肯定的是,未来几年RNA治疗将在药物研究中占有一席之地,降低尚无相对应药物治疗的蛋白质标的并治愈疾病。
撰文 / Rajaneesh K Gopinath
翻译 / Rayean Wu
【本文同步刊载于基因专刊DEC 2019期,更多精彩报导请锁定基因线上】
References
1. https://www.ncbi.nlm.nih.gov/pubmed/29617640
2. https://www.ncbi.nlm.nih.gov/pubmed/30521885
3. https://www.ncbi.nlm.nih.gov/pubmed/29662218
4. https://www.ncbi.nlm.nih.gov/pubmed/31597037
5. http://investors.alnylam.com/news-releases/news-release-details/alnylam-announces-first-ever-fda-approval-rnai-therapeutic
6. http://investors.alnylam.com/news-releases/news-release-details/alnylam-announces-approval-givlaaritm-givosiran-us-food-and-drug
7. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5835633/
8. https://www.ncbi.nlm.nih.gov/pubmed/1690918
9. https://www.ncbi.nlm.nih.gov/pubmed/30795778
10. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6453554/
©www.geneonline.news. All rights reserved. 基因线上版权所有 未经授权不得转载。合作请联系:service@geneonlineasia.com