在组织和肿瘤环境中都可发现 T 细胞和其细胞表面 T 细胞受体(T cell receptor,简称 TCR) 的踪影,它们能调控长效、抗原特异性、效应功能反应(effector response)和免疫记忆反应(memory response)。因此在免疫治疗中,它们扮演相当重要的角色。
T 细胞受体的组成与功能
TCR 为调节 T 细胞的抗原特异性活化的多单元穿膜复合物(multi-subunit transmembrane complex),由 TCRα 和 TCRβ 链等二条不同的多肽链组成,可形成异质双体,依其结构上所形成的不同功能区,可分为细胞膜外侧的 N 端可变区(variable region)、恒定区(constant region)与重链区(H region),而利用穿膜区(transmembrane region)插于细胞膜上以及膜内侧的短细胞质端。二链之间通过二硫键(disulphide bond)连接,每个受体提供单个抗原结合位点。
TCR 借由辨识由抗原呈现细胞(antigen presenting cells,简称 APCs)上的主要组织相容性复合体(major histocompatibility complex,简称 MHC)所呈现的抗原配体,赋予 T 细胞抗原特异性。T 细胞表现的辅助性黏附分子 CD4 和 CD8 也参与在其中,其中 CD4 和第 II 型 MHC 形成的抗原复合体进行辅助辨识,而 CD8 和第 I 型 MHC 形成的抗原复合体进行辅助辨识。TCR 双体在细胞内合成后,需要 CD3γ 、CD3δ、CD3ε、CD3ζ 等 4 种分子组成的复合体(包含 CD3δε 和 CD3γε 等二个异源二聚体以及同源二聚体 CD3ζζ)的协助,才能来到细胞表面。接着,CD3 复合体与 TCR 在 T 细胞表面形成一个稳定且具功能的 TCR 复合体,当 T 细胞遇到抗原时,此 T 细胞复合体中的 TCR 若辨识抗原成功,会透过 CD3 复合体将讯息传递到细胞内部,以启动新蛋白质的合成,进而促使原始 T 细胞进行分裂与分化成作用 T 细胞、辅助性 T 细胞以及毒杀性 T 细胞,来击退外来的病原,如细菌、病毒或癌细胞。
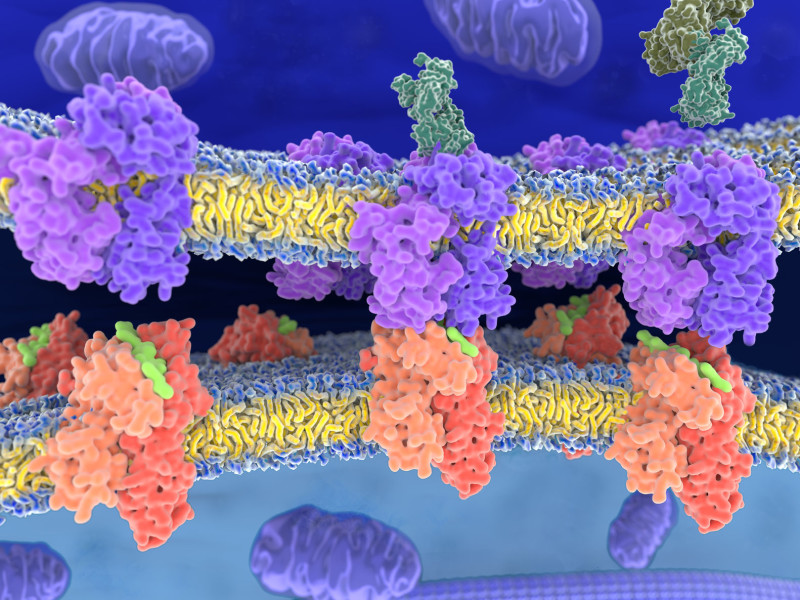
TCR 借由辨识由抗原呈现细胞上的第二型 MHC 所呈现的抗原配体,赋予 T 细胞抗原特异性。
TCR 基因修饰于肿瘤治疗之应用
T 细胞在胸腺内发育时,其 TCR 与自体内源自蛋白质之胜肽呈高亲和力结合时,这些 T 细胞会被摧毁,此过程即称为负面选择(negative selection),就会产生中心耐受性。肿瘤环境也在免疫反应中起关键作用,肿瘤细胞可能会有躲避机制,使抗原呈现细胞不能完全接触 TCR,而 T 细胞无法活化,产生周围耐受性。因此,科学家透过修饰 TCR 基因提升 TCR 肿瘤抗原辨识能力,克服中心耐受性和周围耐受性的限制,进而准确标靶具有特定抗原的肿瘤细胞,达到治疗的效果,成为近几年热门研究方向。
修饰的 TCR 基因疗法是透过表达特异性 TCRα 和 TCRβ 链来改变 T 细胞特异性。肿瘤特异性 TCRα和 TCRβ 链经辨识、分离以及复制到转导载体中,并且转导 T 细胞产生肿瘤抗原特异性 T 细胞。
为了成功产生肿瘤特异性TCR,需要确认合适的标靶序列,这可能从罕见的肿瘤反应性 T 细胞中分离出来,主要有三种方法。第一种方法是透过人类肿瘤蛋白表达人类白细胞抗原(human leukocyte antigen,简称 HLA)系统的转殖基因小鼠,产生包含人类抗原辨识能力的 TCR 的 T 细胞。另一种方法是异体移植(allogeneic)TCR 基因转移,其中肿瘤特异性 T 细胞从肿瘤缓解的患者中分离,并且反应性 TCR 序列从另一个无治疗反应的患者的 T细胞转移到 T 细胞。最后一种方法,体外技术(in vitro)可以用来改变 TCR 的序列,进而提升反应性肿瘤特异性 TCR 与标靶抗原的交互作用,增加 T 细胞击杀肿瘤的活性。
延伸阅读:免疫治疗于癌症之应用T 细胞受体结合人工智能 癌症治疗大跨步
目前许多免疫疗法都建立在已知的抗原基础上,但对于这些抗原的属性以及识别它们的 T 细胞,但仍有许多不清楚之处。为了解决这样的疑问,约翰霍普金斯大学(Johns Hopkins University)医学院研究团队利用人工智能(Artificial Intelligence,简称 AI)创建一套包含各种 TCR 性质的图谱数据库。
该研究团队收集实验室中暴露于病毒的人类 TCR 的基因组序列数据,并使用高性能计算技术来创建一个数字模型(本质上是一个数字地图),他们的目标是聚集相似的 TCR,并可能标靶相同的抗原。他们接着透过无监督学习算法(unsupervised learning algorithm),能够根据受体序列中的相似性将 TCR 定序数据转换为数字距离,并且依它们的功能特异性而聚集。例如,如果二个受体序列相似,则电脑则会在两个序列之间分配短距离级别。如果序列不同,他们收到一个更长的距离排名。一旦数以千计的序列被转换成这些“距离”度量,电脑系统的 AI 算法能在受体之间寻找运作模式。
该研究团队也透过在有肿瘤和无肿瘤的小鼠中,创建了肿瘤抗原特异性 TCR 多样性的 ImmunoMap,其中接近肿瘤的 T 细胞样本中 TCR 的多样性比较远。这些数据可能有助于未来研究团队确定肿瘤如何逃避免疫系统的检测。然而,该研究团队 Jonathan Schneck 博士指出,该研究组还需要积累更多的 ImmunoMap 数据,才能准确地预测哪些患者对免疫疗法才会有效。他也指出,对任何个体患者的免疫疗法反应来说,ImmunoMap 不能将 TCR 与特定抗原配对成功或确定哪些抗原能配对成功,都是很重要的事。最后也希望 ImmunoMap 未来能有助于治疗癌症的疫苗、T 细胞和 TCR 工程化的研发。
延伸阅读:2017 CSCO系列报导(一):肿瘤大数据与人工智能的应用文 / Parker Yang
参考资料:
1. Xing, Y. and Hogquist, K. A. T-cell tolerance: central and peripheral. Cold Spring 2. Harb. Perspect. Biol. (2012). 4, a006957.
3. Sharpe M and Mount N. Dis Model Mech. 2015 Apr;8(4):337-50.
4. Stanislawski T, et al. Nat. Immunol. 2001;2, 962–70.
5. Gao L, et al. Blood. 2000; 95, 2198–203.
6. Schmid DA, et al. J. Immunol. 2010;184, 4936–46.
7. Cancer Immunology Research, 2017; canimm.0114.2017 DOI: 10.1158/2326-6066.CIR-17-0114
8. http://dmm.biologists.org/content/8/4/337
9.https://www.health-holland.com/project/2017/t-cell-receptor-gene-therapy-of-cancer
10. http://idv.sinica.edu.tw/ibswcy/immunology/NTOU9.pdf
11. http://life.nthu.edu.tw/~bioclass/files/980111%20class-1.pdf
12. https://www.sciencedaily.com/releases/2018/01/180108101346.htm
©www.geneonline.news. All rights reserved. 基因线上版权所有 未经授权不得转载。合作请联系:service@geneonlineasia.com





