生物会借由细胞分裂持续替补和修复不堪用的身体部位,若运作得当理应能永续生存。但事实上生物都有其寿命限制,不得不屈服于老化。在 1961 年,美国生理学家 Leonard Hayflick 在培养人类胚胎细胞时即发现这些细胞没办法永无止尽的复制,大约分裂 40-60 次后就会进入休眠状态。当多数细胞都进入休眠,身体就没办法自我修复,组织和器官就会累积各种残缺,最后变得不堪使用 — 这就是老化过程。但是更了解老化机制后,有没有可能打破天命的枷锁?抗老化基因研究正在朝这个目标迈进。
端粒 — 决定人类老化的关键计时器?
“端粒”(Telomere)是位于细胞染色体末端的结构,是由许多重复核酸片段 (在人类为TTAGGG) 组成的 DNA 序列,可避免染色体末端的基因受到破坏或不小心接上其他染色体或基因序列。早在 1930 年代初期,美国遗传学家 Hermann J. Muller 和 Barbara McClintock 就已发现端粒;而到了 1970 年代,美国遗传学家 Elizabeth Blackburn 和 Jack Szostak 更深入阐明端粒的结构和功能,并发现端粒在细胞复制时都会少掉一部份的序列。当端粒短到某种程度后就无法继续保护染色体,细胞也就会进入休眠状态而不再复制。研究人员更发现氧化物质、心理压力、和破坏核酸的外来因素 (如长期曝晒紫外线、抽菸、酗酒等) 也会造成端粒缩短,进而加速老化过程。
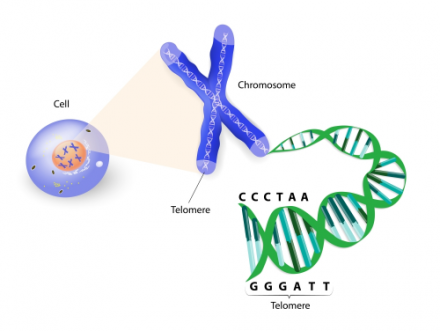
上图:端粒 (Telomere) 是位于染色体末端双链 DNA 的重复序列。每次细胞分裂,端粒变短,直至短到不再分裂。
自己的端粒自己加!
有趣的是,Szostak 教授后来发现酵母菌可在外来的 DNA 两端加上端粒,而 Blackburn 教授的学生Carol W. Greider 更在 1984 年发现可延长端粒的酵素,称之为“端粒酶”。Blackburn、Szostak、和 Greider 教授因其贡献而共同获颁 2009 年诺贝尔生理医学奖。端粒也成为热门的研究主题,每年会产出 1,000 篇以上相关的论文。目前有研究人员利用白血球端粒长度预测未来十年发生心血管疾病与癌症的机率,也有许多研究致力寻找可刺激端粒酶的药物,让端粒维持一定的长度停住老化的脚步。
天生我材必有用 — 为什么生物体需要端粒?
既然端粒酶可以延长端粒长度,让端粒酶持续工作是否就能实现长生不老的梦想?需要不断复制的干细胞、表皮细胞、或内皮细胞,其端粒酶皆相当活跃,端粒长度几乎不变。不过还有另一类细胞也拥有异常勤奋的端粒酶,就是众人闻之色变的癌细胞。它们毫不节制的生长,不受老化限制;而动物实验也显示在活体内大量表现端粒酶,将会大幅提高皮肤黑色素瘤、肺癌、以及胶质细胞瘤的发生风险。目前研究人员致力于找到长生和癌症之间的平衡,以避免顾此失彼、弄巧成拙。相信大家都希望得永生,但并不希望以长生不老的癌细胞形式存活在这个世界吧?!
©www.geneonline.news. All rights reserved. 基因线上版权所有 未经授权不得转载。合作请联系:service@geneonlineasia.com
延伸阅读:基因与老化系列专文(二) 延年益寿的灵丹?参考文献:
1. 科技部高瞻自然科学教学资源平台中对于端粒的介绍
http://highscope.ch.ntu.edu.tw/wordpress/?p=12879
2. 诺贝尔奖得主Elizabeth Blackburn大师在2015年底于Science杂志所发表关于端粒的最新见解
Blackburn EH et al. Human telomere biology: A contributory and interactive factor in aging, disease risks, and protection. Science 2015; 350:1193-8.