在台湾,恶性肿瘤已高居十大死因首位多年,根据统计,2016 年每十万人有 203.1 人死于癌症,其中以肺癌、肝癌、大肠直肠癌的死亡人数最多 [1]。而癌症发生率逐年上升,2011 年时每十万人有 261.1人新诊断罹癌,2015 年时每十万人有 303.8 人新诊断罹癌,其中发生人数最多之癌别为大肠直肠癌、肺癌及女性乳癌 [2]。
过去癌症治疗以化疗和标靶治疗为主。化疗是以药物去干扰细胞的复制分裂,达到抑制癌细胞生长的作用,但同时也会作用在正常细胞,导致许多副作用如骨髓抑制和落发 [3]。标靶治疗则是以药物针对促进癌细胞生长的讯息因子传递路径进行抑制,以干扰癌细胞生长,因较具专一性,所以全身性的副作用较低 [4]。
虽然化疗药物和标靶药物可抑制癌细胞生长,但两者用于癌症治疗的效果,皆仅能维持一段时间。以晚期非小细胞肺腺癌为例,现行一线化疗组合的首选为 cisplatin 搭配 pemetrexed,其无疾病恶化时间约 5.1 个月,而平均存活时间为 10.3 个月 [5]。到了二线的化疗,使用 docetaxel 仅能带来 10.6 周疾病无恶化及 7.0 个月的存活时间之效益 [6]。若是带有表皮生长因子受体 (EGFR) 突变之患者,使用标靶药物可将无疾病恶化时间延长到 11-13 个月 [7-8]。而在晚期黑色素瘤,使用化疗药品 dacabarzine 的肿瘤客观反应率仅 15.3%,有效时间仅 5-7 个月 [9],而若是带有 BRAF V600E 突变之患者,使用标靶药物可将无疾病恶化时间延长到 9.3-11.4 个月 [10-11]。
人体的免疫系统,能经由 T 细胞辨识外来抗原,进而消灭这些外来物。研究显示,细胞在分裂的过程,可能会因突变而产生新抗原 [12],其中以黑色素瘤、非小细胞肺癌、膀胱癌、肾细胞癌等癌细胞产生突变的比例较高,所以也带有较多可被 T 细胞辨识的抗原 [13]。当树突状细胞接触到这些抗原,可经由树突状细胞的 B7 和 T 细胞上的 CD-28 结合将 T 细胞活化,进而去辨识癌细胞上的抗原并攻击 [14]。在一般情形下,T 细胞上的 cytotoxic T-lymphocyte antigen-4 (CTLA-4) 会和 CD-28 竞争与 B7 的结合,减少 T 细胞的活化。此外 T 细胞上带有 programmed cell death-1 (PD-1),而表皮细胞、内皮细胞上有配体 PD-L1,当两者结合后,T 细胞的活性会被减弱,这两者为存在体内之负向调控机制,用来保护 T 细胞造成其他正常细胞之伤害。然而,癌细胞表面也存在 PD-L1,使得 T 细胞无法维持活性,失去消灭癌细胞的能力 [15]。
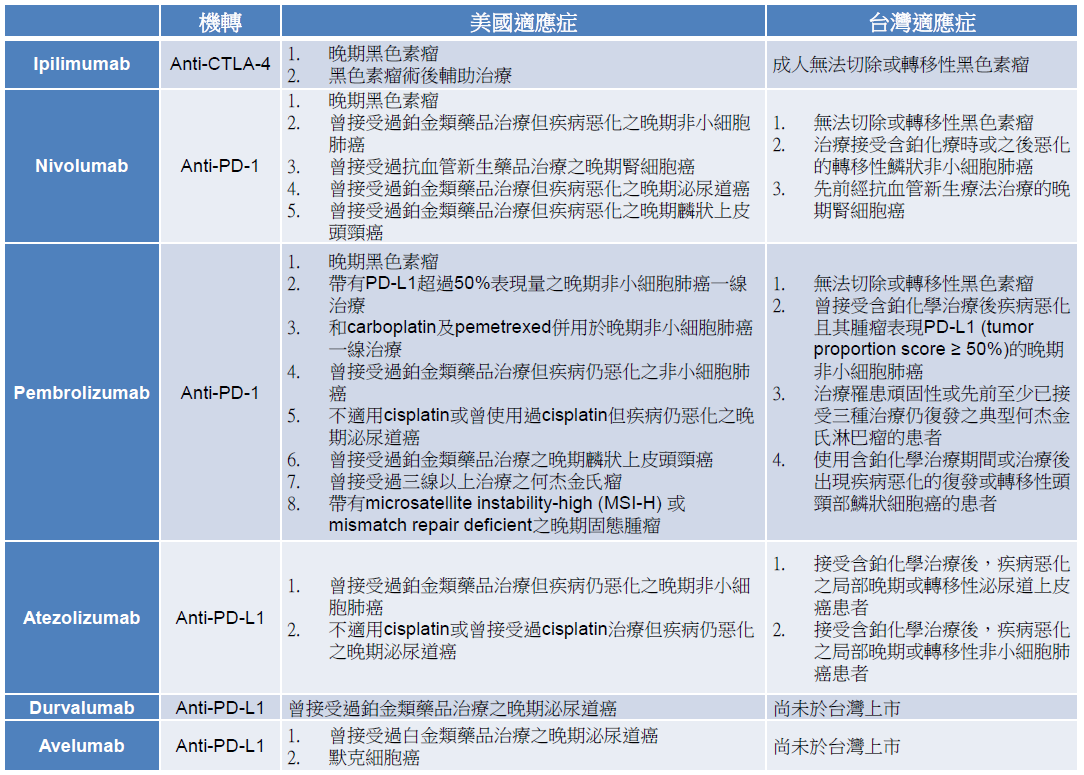
目前已有可调控 T 细胞活性的免疫治疗药品上市,包括作用在 CTLA-4 的 iplimumab、作用在 PD-1 的nivolumab、pembrolizumab,以及作用在 PD-L1 的 atezolumab、durvalumab、avelumab (表一),这类药品被称作免疫查核点抑制剂 (immune checkpoint inhibitor)。这些药品经由阻断 B7 和 CTLA-4 或 PD-1 和 PD-L1 的结合,可增加 T 细胞活性,为癌症治疗带来新契机。
表一 查核点抑制剂及其适应症
在晚期黑色素瘤方面,ipilimumab 用于二线治疗,将存活期延长到 10.1 个月,和 dacarbazine 并用于一线治疗,则将存活期增加到 11.2 个月 [16-17]。Nivolumab 用于二线治疗,存活期为 16.8 个月,单独用于一线治疗时,无疾病恶化时间为 6.9 个月,和 ipilimumab 并用于一线治疗时,无疾病恶化时间更可延长到 11.5 个月 [18-19]。Pembrolizumab 用于一线治疗,无疾病恶化时间为 4-5 个月,相较单独使用 ipilimumab 增加约 2 个月 [20]。而后,这些药品陆续在非小细胞肺癌、肾细胞癌、泌尿道癌、头颈癌的临床试验,展现了比现行标准治疗更优异的疗效 (表二) [21-33],尤其在 KEYNOTE-024 这个针对 PD-L1 表现量超过 50% 且未曾接受治疗的非小细胞肺癌患者之试验,pembrolizumab 相较化疗可显著延长无疾病恶化时间 (10.3 vs. 6.0 个月)、六个月存活率 (80.2% vs. 72.4%) 及肿瘤客观反应率 (44.8% vs. 27.8%),成为第一个可将免疫治疗用于晚期肺癌一线治疗的适应症 [22]。
表二 查核点抑制剂于主要适应症之疗效†
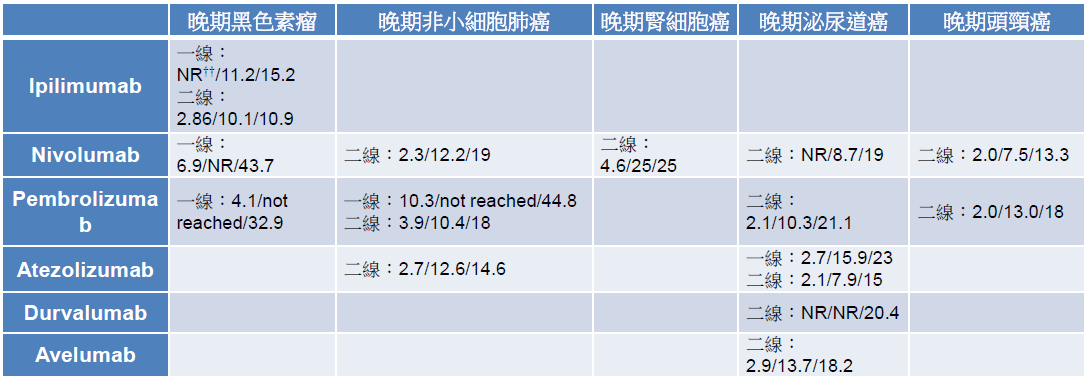 †资料以右列方式呈现:无疾病恶化存活期(月)/总存活期(月)/肿瘤反应率(%)
†资料以右列方式呈现:无疾病恶化存活期(月)/总存活期(月)/肿瘤反应率(%)
††NR: not report
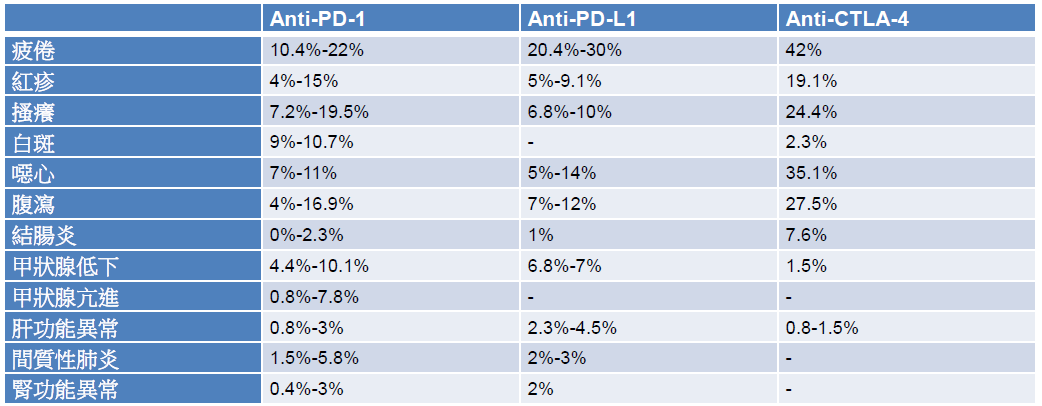
免疫治疗虽然不是直接攻击癌细胞,相较于传统化疗,较没有骨髓抑制的副作用,但使用上仍有需注意之处。因免疫治疗是活化 T 细胞来达到治疗目的,在治疗过程中,可能产生与免疫相关的不良反应 (immune-related adverse events, irAE),包括红疹、白斑、结肠炎、腹泻、甲状腺功能异常,发生率约 10%-20%,其他可能发生的 irAE 还包括肝功能异常、间质性肺炎、肾功能异常,其发生率约 5% 以下 (表三) [16-33]。irAE 的发生,可能约在开始治疗后的一至四个月出现 [34]。在处理通则上,需先排除其他可能的原因,一旦怀疑是 irAE,症状较轻者 (严重程度第一到第二级),可投予局部或较低剂量的全身性类固醇 (prednislolone 0.5-1 mg/kg),症状较严重者 (严重程度第三到第四级),可投予较高剂量的类固醇 (prednisolone 1-2 mg/kg),对于结肠炎、肝功能异常或间质性肺炎,若使用类固醇三天后症状仍无改善,可再加上其他免疫抑制剂,例如 infliximab、mycophenolate [35]。
表三 查核点抑制剂之主要不良反应
在最新的美国癌症治疗指引中,免疫治疗于多个晚期癌症皆为建议之治疗选择。目前 pembrolizumab、nivolumab和 ipilimumab 已在台湾上市,但因健保尚未给付,临床使用仍受限制。以 pembrolizumab 为例,其施打方式为每三周一次,一次投予 2 mg/kg 或固定剂量 200 mg,平均每月花费约 17 万 – 34 万元,nivolumab 平均每月花费约 22 万 – 29 万元,ipilimumab 平均每月花费约 80 万 – 106 万元,皆低于美国和日本的价钱 (表四) [36-37]。虽然台湾价钱较国外略低,但对多数病患仍是高额花费,盼中央健保早日纳入给付,嘉惠癌症病患。
表四 Nivolumab、pembrolizumab和ipilimumab于台湾、美国、日本之每月费用比较*
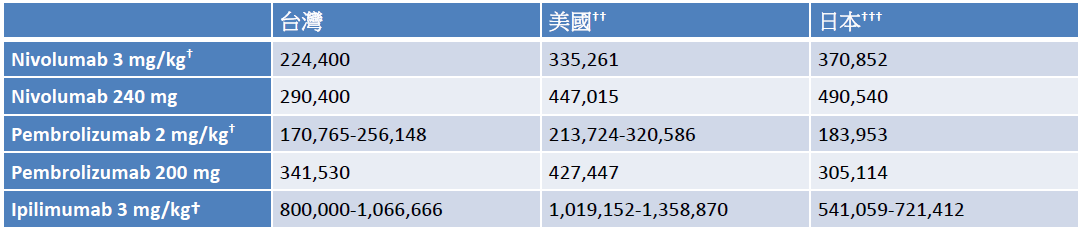 *费用以新台币呈现
*费用以新台币呈现
†以体重60公斤计算
††以106年8月14日台湾银行汇率美金1元=新台币30.492元计算
†††以106年8月14日台湾银行汇率日币1元=新台币0.2787元计算
虽然免疫治疗已为晚期癌症带来比现行标准治疗好的效果,但大家仍在找寻能进一步提升疗效的方式。第一,是探讨可用来预测治疗效果的生物标志 (biomarkers)。然而,从目前的临床试验中发现,除了 pembrolizumab 在非小细胞肺癌的治疗外,PD-L1 的表现量与治疗效果并无明显相关性 [38]。第二,是将免疫治疗并用其他治疗。在KEYNOTE-021 研究中,并用 pembrolizumab 和化疗,其肿瘤客观反应率为 55%,较单独使用化疗增加了 24%,且不限定用于 PD-L1 高表现量者 [39]。在 ECHO-202/KEYNOTE-037 试验,并用 pembrolizumab 和 epacadostat (IDO-1抑制剂) 来治疗晚期非小细胞肺癌,其肿瘤客观反应率为 35% [40]。而对头颈癌患者,pembrolizumab 和同步放射线化疗并用的效果,也正于临床试验评估中 [41]。
免疫治疗透过崭新的抗癌机转,为癌症治疗带来希望与选择,相较传统治疗,免疫疗法的副作用虽较少,但使用过程中仍需仔细监测相关症状及检验数值。如何提升免疫治疗的效果,例如寻找可预测疗效的生物标志或合并其他治疗,是当前仍在努力的方向,也是热门的研究课题。
延伸阅读:中研院 刘扶东副院长:浅谈精准医学免疫疗法治疗癌症的可能性撰文 / 郭俊男1,2、张伟峤2,3
1台北医学大学 – 台北市立万芳医院 药剂部
2台北医学大学药学院药学系
3台北医学大学药学院临床基因体学暨蛋白质体学硕士学位学程
参考文献:
- Ministry of Health and Welfare in Taiwan. (Accessed August 15, 2017 at http://www.mohw.gov.tw/cp-16-33598-1.html)
- Taiwan cancer registry. (Accessed August 15, 2017 at http://tcr.cph.ntu.edu.tw/main.php?Page=A5B2)
- Chabner BA. In: L. Brunton, B. Chabner and B. Knollmann eds. Goodman and Gilman’s the Pharmacological Basis of Therapeutics. 12e ed. New York: McGraw-Hill; 2011:1-9
- Sharkey RM and Goldenberg DM. Targeted therapy of cancer: New prospects for antibodies and immunoconjugates. CA Cancer J Clin 2006; 56: 226-43
- Scagliotti GV, Parikh P, von Pawel J, et al. Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer. J Clin Oncol 2008; 26: 3543-51
- Shepherd FA, Dancey J, Ramlau R, et al. Prospective randomized trial of docetaxel versus best supportive care in patients with non-small-cell lung cancer previously treated with platinum-based chemotherapy. J Clin Oncol 2000; 18: 2095-103
- Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol 2011; 12: 735-42
- Sequist LV, Yang JC, Yamamoto N, et al. Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol 2013 20; 31: 3327-34
- Bhatia S, Tykodi SS, Thompson JA. Treatment of metastatic melanoma: an overview. Oncology (Williston Park) 2009 ; 23: 488-96
- Long GV, Stroyakovskiy D, Gogas H, et al. Combined BRAF and MEK inhibition versus BRAF inhibition alone in melanoma. N Engl J Med 2014; 371: 1877-88
- Robert C, Karaszewska B, Schachter J, et al. Improved overall survival in melanoma with combined dabrafenib and trametinib. N Engl J Med 2015; 372: 30-9
- Schumacher TN, Schreiber RD. Neoantigens in cancer immunotherapy. Science 2015; 348: 69-74
- Alexandrov LB, Nik-Zainal S, Wedge DC, et al. Signatures of mutational processes in human cancer. Nature 2013; 500: 415-21
- Chen DS, Mellman I. Oncology meets immunology: the cancer-immunity cycle. Immunity 2013; 39: 1-10
- Dong H, Strome SE, Salomao DR, et al. Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion. Nat Med 2002; 8: 793-800
- Robert C, Thomas L, Bondarenko I, et al. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med 2011; 364: 2517-26
- Hodi FS, O’Day SJ, McDermott DF, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010; 363: 711-23
- Topalian SL, Sznol M, McDermott DF, et al. Survival, durable tumor remission, and long-term safety in patients with advanced melanoma receiving nivolumab. J Clin Oncol 2014; 32: 1020-30
- Larkin J, Chiarion-Sileni V, Gonzalez R, et al. Combined Nivolumab and Ipilimumab or Monotherapy in Untreated Melanoma. N Engl J Med 2015; 373: 23-34
- Robert C, Schachter J, Long GV, et al. Pembrolizumab versus Ipilimumab in Advanced Melanoma. N Engl J Med 2015; 372: 2521-32
- Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med 2015; 373: 1627-39
- Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med 2016; 375: 1823-33
- Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016; 387: 1540-50
- Fehrenbacher L, Spira A, Ballinger M, et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet 2016; 387: 1837-46
- Motzer RJ, Escudier B, McDermott DF, et al. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med 2015; 373: 1803-13
- Sharma P, Retz M, Siefker-Radtke A, et al. Nivolumab in metastatic urothelial carcinoma after platinum therapy (CheckMate 275): a multicentre, single-arm, phase 2 trial. Lancet Oncol 2017; 18: 312-322
- Bellmunt J, de Wit R, Vaughn DJ, et al. Pembrolizumab as Second-Line Therapy for Advanced Urothelial Carcinoma. N Engl J Med 2017; 376: 1015-26
- Balar AV, Galsky MD2, Rosenberg JE, et al. Atezolizumab as first-line treatment in cisplatin-ineligible patients with locally advanced and metastatic urothelial carcinoma: a single-arm, multicentre, phase 2 trial. Lancet 2017; 389: 67-76
- Rosenberg JE, Hoffman-Censits J, Powles T, et al. Atezolizumab in patients with locally advanced and metastatic urothelial carcinoma who have progressed following treatment with platinum-based chemotherapy: a single-arm, multicentre, phase 2 trial. Lancet 2016 ; 387: 1909-20
- Powles T, O’Donnell PH, Massard C, et al. Updated efficacy and tolerability of durvalumab in locally advanced or metastatic urothelial carcinoma. J Clin Oncol 2017; 35: Abstract 286
- Apolo AB, Infante JR, Balmanoukian A, et al. Avelumab, an Anti-Programmed Death-Ligand 1 Antibody, In Patients With Refractory Metastatic Urothelial Carcinoma: Results From a Multicenter, Phase Ib Study. J Clin Oncol 2017; 35: 2117-24
- Ferris RL, Blumenschein G Jr, Fayette J, et al. Nivolumab for Recurrent Squamous-Cell Carcinoma of the Head and Neck. N Engl J Med 2016; 375: 1856-67
- Seiwert TY, Burtness B2, Mehra R, et al. Safety and clinical activity of pembrolizumab for treatment of recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-012): an open-label, multicentre, phase 1b trial. Lancet Oncol 2016; 17: 956-65
- Eigentler TK, Hassel JC, Berking C, et al. Diagnosis, monitoring and management of immune-related adverse drug reactions of anti-PD-1 antibody therapy. Cancer Treat Rev 2016; 45: 7-18
- JHaanen JBAG, Carbonnel F, Robert C, et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017; 28 (Suppl 4): iv119–iv142
- Drug information in UpToDate. (Accessed August 15, 2017, at http://www.uptodate.com)
- Drug information in Kyoto Encyclopedia of Genes and Genomes. (Accessed August 15, 2017, at http://www.kegg.jp)
- Sunshine J, Taube JM. PD-1/PD-L1 inhibitors. Curr Opin Pharmacol 2015; 23: 32-8
- Langer CJ, Gadgeel SM, Borghaei H, et al. Carboplatin and pemetrexed with or without pembrolizumab for advanced, non-squamous non-small-cell lung cancer: a randomised, phase 2 cohort of the open-label KEYNOTE-021 study. Lancet Oncol 2016; 17: 1497-1508
- Gangadhar TC, Schneider BJ, Bauer TM, et al. Efficacy and safety of epacadostat plus pembrolizumab treatment of NSCLC: Preliminary phase I/II results of ECHO-202/KEYNOTE-037. J Clin Oncol 2017; 35(suppl 15): Abstract 9014
- Machiels JPH, Licitra L, Rischin D. KEYNOTE-412: Pembrolizumab (pembro) in combination with chemoradiation versus chemoradiation alone in locally advanced head and neck squamous cell carcinoma (LA-HNSCC). J Clin Oncol 2017; 35(suppl 15): Abstract TPS6090
©www.geneonline.news. All rights reserved. 基因线上版权所有 未经授权不得转载。合作请联系:service@geneonlineasia.com





