2019 BioJapan 是日本生物製藥和再生醫學產業的重要展會,也是日本與亞洲各國連結國際的重要平台,會中也有許多精彩的專題演講,有來自 34 個國家、1,200家公司和組織參加。基因線上特別整理抗體和核酸藥物發展與趨勢的最新臨床應用及未來展望。
次世代抗體技術與藥物開發
Switch 抗體技術 提升癌症免疫療法專一性及安全性
雖然抗體藥物不斷創新,但仍可能會有脫靶產生細胞毒性的疑慮。因此,Chugai Pharmabody Research 開發出一種 Switch 抗體技術,它需先結合疾病中的特定代謝分子才能與抗原結合。ATP 是一個稱職的 Switch 代謝分子,它在腫瘤微環境中的細胞外濃度大於 100 M,遠高於正常組織的細胞外濃度 30 nM。在他們的小鼠模型研究中,證實 Switch 抗體能夠在高 ATP 實體瘤微環境下與標靶抗原結合,而不會與正常組織或血漿中的抗原結合,專一性優於一般體,且抑制腫瘤效果優於非 Switch 抗體。簡言之,Switch 抗體技術提升癌症免疫療法的專一性及安全性。
免疫細胞受體資料庫建立 推動個人化治療進展
每個人因其免疫細胞受體(TCR、BCR)辨識抗原的能力不同,感染防禦能力、自身免疫性疾病和癌症痕跡也有所不同。若能建立含有 TCR、BCR 的免疫資料庫,就能提供相關數據輔助人們進行抗原偵測、細胞治療和藥物開發、診斷和預測。免疫資料庫的建立從收集正常細胞、腫瘤細胞、其餘免疫疾病細胞開始,然後透過高通量結構建模 AI 軟體和單細胞分析技術分析其 TCR、BCR 的結構、基因表現、功能。簡言之,該資料庫不僅幫助生技業者開發抗體新藥,也能推動個人化免疫治療的進展。
VHH 抗體藥物臨床進展
重鏈抗體(heavy chain antibody, HcAb)是存在於駱駝科動物內、不包含輕鏈且僅由一個重鏈可變區組成的新型抗體分子(heavy chain variable domain of heavy-chain antibody, VHH)。VHH 抗體的相對分子量為 12 K,相當於普通抗體的 1 /14 (170K),它可在大腸桿菌中表現,且具有容易編輯和熱穩定性高的特點。因此,它兼具傳統抗體與小分子藥物的優勢,克服傳統抗體的開發週期長、穩定性較低,保存條件嚴格等缺點。2018 年,歐盟核准第一個 VHH 抗體藥物 Cablivi(caplacizumab)上市,隔年美國 FDA 核准 caplacizumab 上市。目前正在進行臨床試驗的 VHH 抗體藥物有 ozoralizumab、M1095、vobarilizumab、LCAR-B83M 等(表一)。
表一、VHH抗體藥物臨床現況(2020/05/04更新)
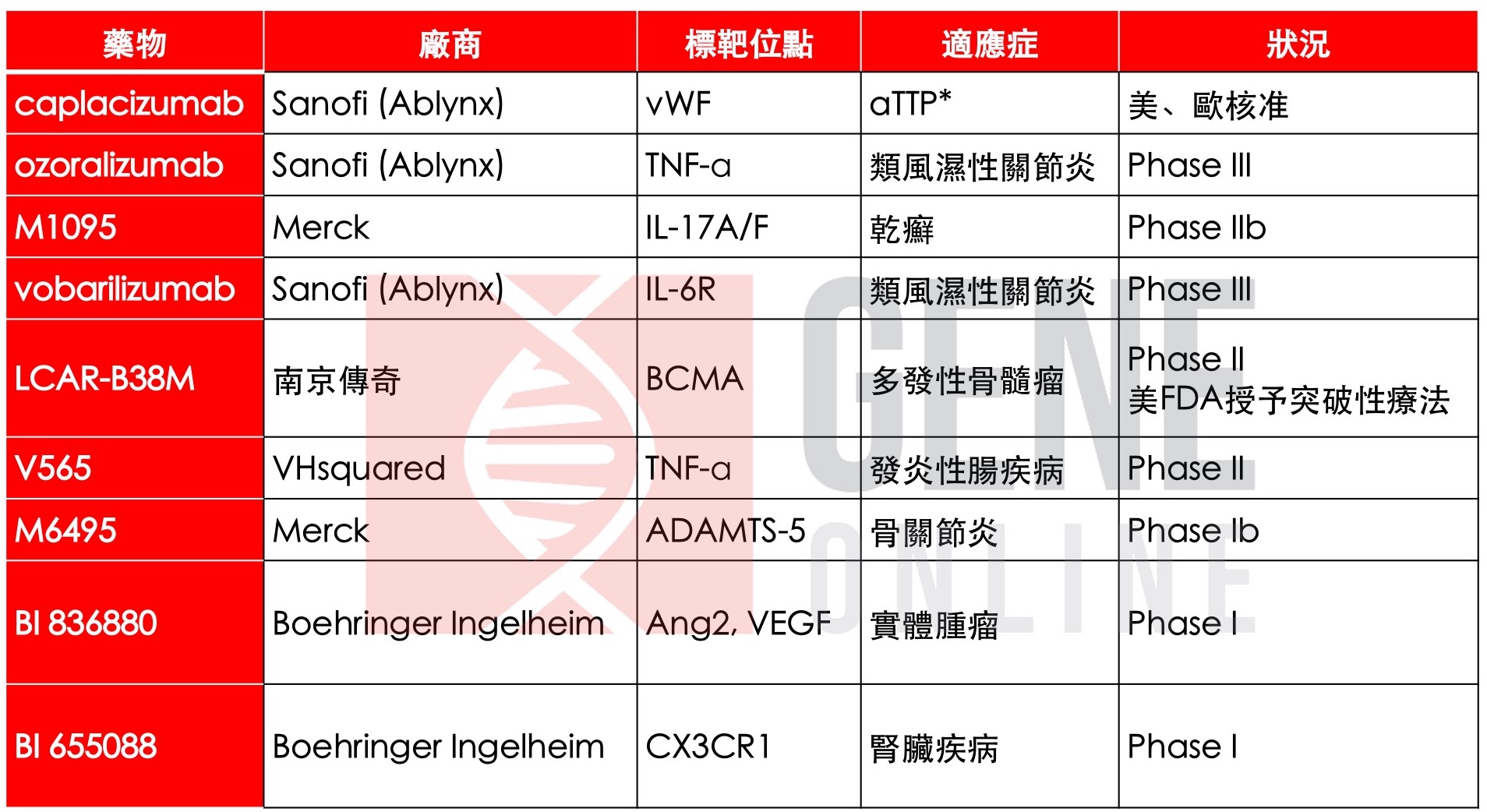
* aTTP: 後天性血栓性血小板减少性紫癜 (acquired thrombotic thrombocytopenic purpura)
核酸藥物
修飾主鏈立體化學結構以優化寡核苷酸藥物
反義寡核甘酸(antisense oligonucleotide, ASO)會與 mRNA 互補配對後,招募 RNase H,後者再標靶 mRNA 進行剪切,阻斷它進行轉譯成蛋白。然而,單核甘酸多型性(single nucleotide polymorphism, SNP)會降低 RNase H 的活性和準確性,而產生錯誤配對。因此,透過主鏈立體化學修飾,解決上述配對錯誤的問題。另外,主鏈立體化學修飾也提升外顯子跳躍(exon skipping)寡核苷酸的活性。例如,使用主鏈立體化學修飾的 ASO 促進 2A型Usher 症候群(遺傳眼科疾病)病人的USH2A 外顯子13 跳躍,以達到治療的效果。
突破 RNAi 藥物運輸的挑戰 以 Onpattro 為例
一般來說,將 RNAi 藥物準確地運輸到器官、細胞、甚至細胞質上,仍是需要面對的挑戰。第一個獲得 FDA 和歐盟核准的RNAi 藥物 Onpattro,則是成功的案例,它是使用 RNAi 將脂質納米顆粒(lipid nanoparticles, LNPs)的方法,將它輸送到肝臟,治療遺傳性多發性神經病變。該 LNPs 包含 DLin-MC3-DMA、PEG2000-C-DMG、DSPC 和膽固醇等四種脂質賦形劑,可保護活性成分 ALN-18328 不被循環系統中核酸內切酶和核酸外切酶的降解。接著,Onpattro 需透過載脂蛋白 E(apolipoprotein E)精準地與肝細胞上的低密度脂蛋白受體結合,隨後發生胞吞作用,siRNA 再標靶至 TTR mRNA 上,以降解它,達到治療效果。
反義寡核苷酸(ASO)治療脊髓性肌肉萎縮症
脊髓性肌肉萎縮症(spinal muscular atrophy, SMA)為一種體染色體突變所造成的遺傳性疾病,當其二條染色體的 SMN1 基因都缺失時,才會發病。SMN2 基因具有補償性的效果,當 SMN1 基因缺陷時,SMN2基因數量越多,越能延後及緩解 SMA 的症狀發生。Nusinersen 是一種反義寡核苷酸(ASO),注射到圍繞脊髓,能改變或修正 SMN2 mRNA的剪接,以增加完整的 SMN 蛋白製造。該藥於 2016 年獲 FDA 核准上市,日本也於 2017 年核准它上市。因此,SMA 基因體研究和nusinersen,可作為未來藥物開發治療神經性疾病的參考模型。
異源雙鏈寡核苷酸藥物
異源雙鏈寡核苷酸(heteroduplex oligonucleotide, HDO)是一種全新的寡核苷酸藥物。有別於 siRNA的雙鏈RNA 和 ASO的單鏈DNA,HDO由 DNA/LNA 及其互補RNA(cRNA)組成。在小鼠實驗中,以 tocopherol 作藥物載體,分別結合 ASO 、HDO 的cRNA,比較二者運輸效果。結果顯示,tocopherol 結合 HDO 組的HDO向肝臟的運輸成效為 tocopherol 結合 ASO 組的 4.8 倍。另外,以 tocopherol 結合 HDO 組,能通過血腦障壁(BBB),有效抑制每一個腦部區域的 Malat-1 基因表現達 70%-90%。總結以上,HDO 不僅提供了一個新穎的治療肝臟和腦部疾病的新方法,更為核酸藥物開闢了新的視野。
延伸閱讀:BioJapan 2018 精彩回顧:核酸藥物進行式總結
日本生物製藥研究和產業發展都為世界領先者,僅次於歐美, 特別是抗體和核酸研究已耕耘多年,期望在未來創造巨大的生物經濟。
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com