今年(2022)9 月 3 日中華民國癌症醫學會將舉辦 2022 MGTO (Molecular Guided Treatment Option) Academy II 研討會,即將討論 Molecular Tumor Board 在各項腫瘤臨床上的相關指引與治療決策。
Molecular Tumor Board (MTB) 是什麼?
Molecular Tumor Board (以下簡稱 MTB)中文譯為分子腫瘤委員會,是目前以診斷、期別、及治療討論為主體之傳統腫瘤委員會,再加入以精準醫學導向的腫瘤聯合討論會,納入分子生物學資訊主要包括基因组學 (Genomics)、外顯子组學 (Exomics)、蛋白组學 (Proteinomics)等,在委員會中廣納不同領域的專家,以專家擅長的領域提出各種方案,藉由各種溝通討論來提供針對各病人所需要且最適合的個人化精準治療方案。
次世代定序(next-generation sequencing, 以下簡稱 NGS)的出現儼然成為目前腫瘤臨床診斷及治療步驟中不可或缺的一部分。在給予治療前,NGS 結果可以呈現出哪種病人符合使用試驗中藥品而給予將其納入臨床試驗機會。但 NGS 數據還可以揭示其他與臨床相關的資訊,例如遺傳性基因變異(hereditary gene mutation)、藥物治療相關基因變異(pharmacogenomics findings) 、複製性造血驅動因素(clonal hematopoiesis drivers)等,這些重要資訊皆可影響臨床決策的制定。必須了解的是,NGS 在臨床上的解讀以人工解讀為主,因此可能因解讀不同而導致醫療團隊在選擇治療上增加挑戰。首先,要辨識出變異主要來自醫學、生物和生物資訊學各領域所開發的眾多資源,而這些領域的資料並不容易整合。其次,即便是標準以及規則達成一致的狀況之下,如何決定臨床治療的優先順序在臨床決策中至關重要。第三、在等待治療的期間,醫師必須根據檢測結果來與對應治療互相匹配,而這些治療組合會因個別病人狀況而不斷的變化,如果不能在有效的時間內針對病人報告提出相關治療方案,將可能會造成精準癌症醫學計畫的失敗而導致病人受到傷害。基於以上的原因,愈來愈多國家或地區希望建立臨床決議支持系統(clinical decision support system),而從而誕生分子腫瘤委員會(Molecular Tumor Board),廣納各領域專家,根據每位病人聯合評估病況後,給予適當的個人化治療方案。
MTB 的臨床應用可提升病人預後
MTB 在癌症治療上的臨床應用,可說是近年來各國家醫療團隊都積極投入的發展方向,因為聯合各領域專家們所制定的個人化精準治療方案可有效提升病人的預後。以下為臨床應用的幾個文獻分享:
Tamborero 等人於 2022 年所發表的文獻中探討歐洲國家如何應用 MTB 來支持臨床決策。文獻中提到醫療團隊在對於腫瘤精準治療上愈來愈需要更多的臨床支持系統來達到成效。因此,在歐洲 Cancer Core Europe 的支持下創立了所謂的 Molecular Tumor Board Portal (MTBP),是利用一個結合學術與臨床的決策支持系統(Academic Clinical Decision Support System)進而建立整合科學與技術的平台,以共享及運用 NGS 的數據。而透過專家所認可的流程系統將腫瘤的分子資訊與臨床治療和反應做連結,促使達到決策上的一致性及利於後續結構性數據的紀錄。運用病患報告中的豐富訊息,有助於在虛擬分子腫瘤委員會於會議期間互動且對複雜病例進行協作討論。 總結來說,MTBP 能更好地應對精準腫瘤學所帶來的挑戰且加速新興生物標記的使用。而 MTBP 在偵測分子變異時的相關流程可參考圖一:
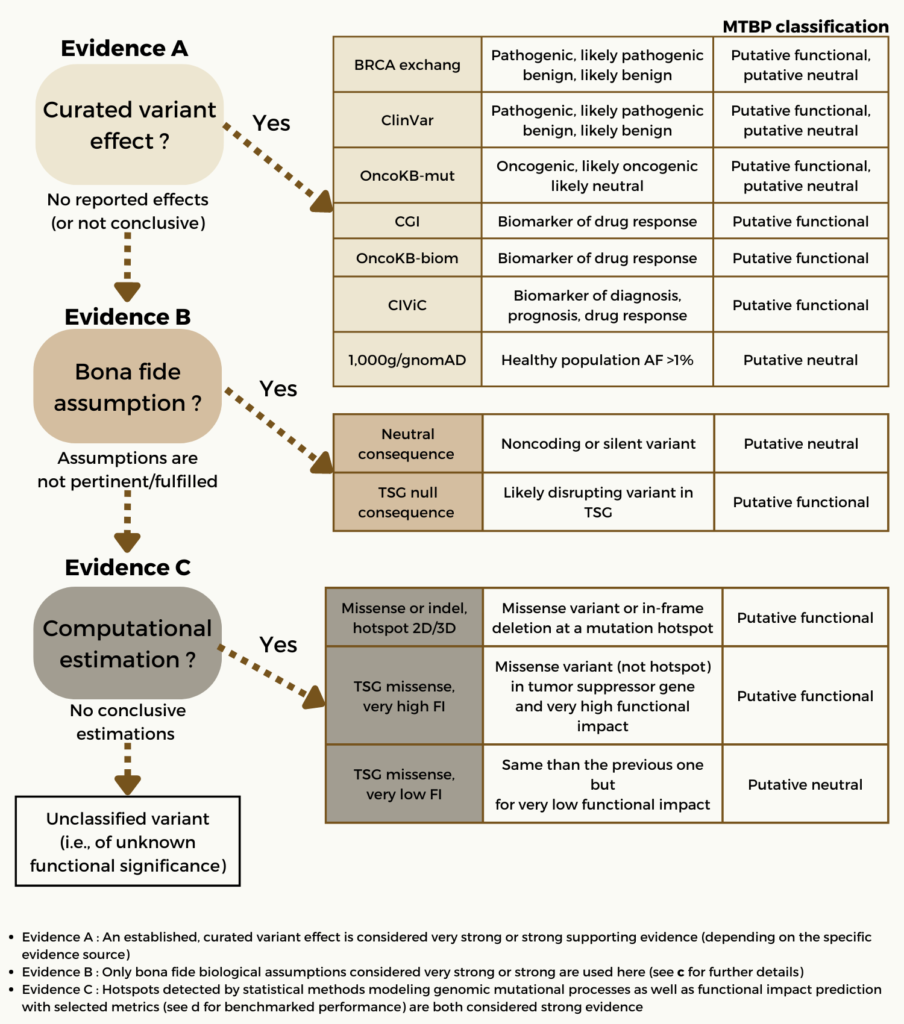
(Source: Tamborero et al. , 2022. https://www.nature.com/articles/s43018-022-00332-x.pdf)
而針對腫瘤樣本中癌症生物標記的運用層級,文獻中建議以下的流程 (參閱圖二)。MTBP 按照 ESMO/ESCAT 量表對腫瘤中發現的癌症生物標記(診斷、預後和藥物反應)進行排名,並於方法上進行兩個小微調。 同時發現與分子病理學協會、美國臨床腫瘤學會和美國病理學家學院 (AMP/ASCO/CAP) 所提出的治療行為相似(左邊一列)。下圖總結了 MTBP 如何根據病患腫瘤與生物標記報告的 (i) 變異和 (ii) 癌症類型的一致性以及 (iii) 支持生物標記效應的臨床證據(根據 MTBP 所使用的生物標記知識庫對每項生物標記的可操作性進行分類 )。
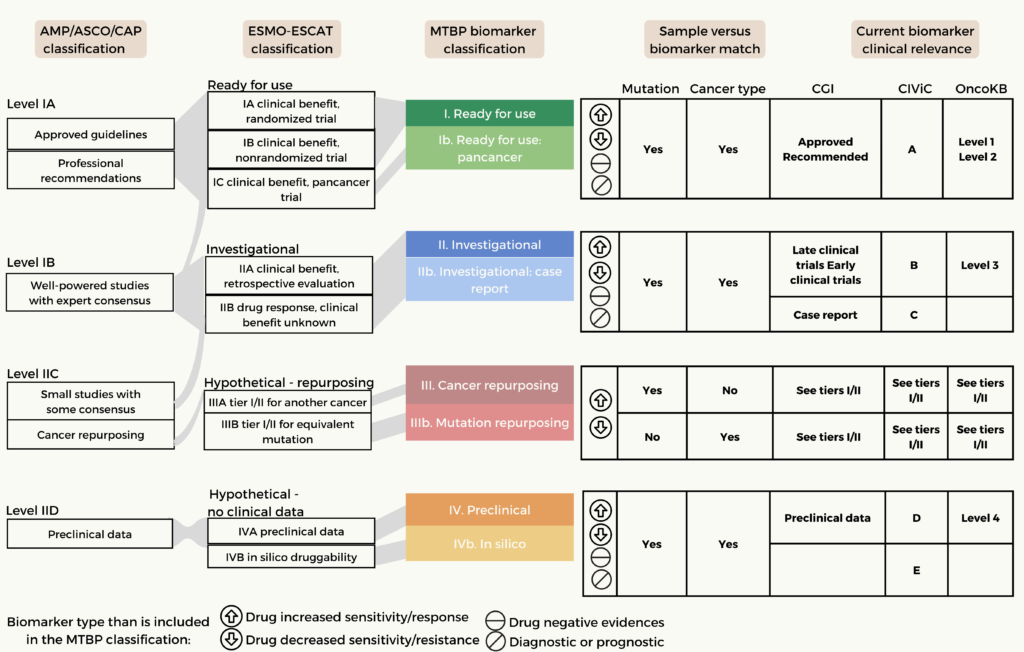
(Source: Tamborero et al. ,2022. https://www.nature.com/articles/s43018-022-00332-x.pdf)
另一篇 2022 年由 Klauss 等人發表的文獻則探討目前治療腫瘤的臨床決策上運用 MTB 決議的比例。在文中提到,雖然 MTB 已成為在各類腫瘤治療討論時所採取的模式,亦是認證的強制性品質衡量標準,但目前仍缺乏明確證據佐證在 MTB 會議中所提出的建議是否與臨床指引共識一致,且是否適合臨床運用。 文中觀察在德國 University Cancer Center Leipzig (UCCL) 中 MTB 針對胃癌的建議與當下德國臨床指引的吻合度,觀察時間為期三個月。他們創造一套客觀的分類系統來評估吻合度。每個納入 MTB 討論的病例,將針對每項指引和MTB建議的治療匹配程度來觀察兩者間的吻合情形。對於一些有差異性的病例,則會進行根本原因以及影響因素的相關調查與分類。 觀察結果顯示,兩者間高達 76% 的吻合度,而另外 16% 的差異性則主要是因為兩邊所納入討論的標準不同或是病患的併發症不同所導致的差異性。其餘 8%無法確定吻合度,主要是因為沒有相對應的指引可以參考。在臨床應用上,有 64% 的病例完全依據 MTB 的建議進行治療,21% 的病例治療出現差異性,主要是因為病患的併發症原因還有就是由一些病患本身的意願所導致。而這項研究也發現,在一些體能狀態下降(ECOG-PS≥2)以及使用緩和預期性治療(palliative intended therapy)(P= 0.002/0.007)的病患中,對於指引以及 MTB 的建議的吻合度明顯降低。
由 UC San Diego 腫瘤醫師 Kato 等人於 2020 年所發表的文獻中也證實藉由 MTB 運用所產生的臨床決策明顯有助於病患的臨床治療。文中也提到如詮釋相關的分子變異數據以及取得合適的治療或臨床試驗,但仍然有許多疾病對單一治療產生抗藥性。為了提供更精準的治療,MTB 委員會全面審查了病患的病況,並建議擬定 N-of-One 治療後由主治醫師來實施。總體而言,在納入的 429 位病患中有 265 名可符合治療評估的病患(62%)同時與超過 1 種推薦藥物匹配。另外,86 名病患 (20%) 採取與 MTB 所建議的所有藥物(包括組合方法)做為治療方案,而有 38% 的病患則接受了主治醫師所選擇的治療方案,最後這組病患與 MTB 所建議的方案不匹配或匹配程度低。研究結果顯示,接受 MTB 所建議的治療方案相較於主治醫師選擇治療方案,病患無論是無疾病惡化存活期 (Progression Free Survival, PFS) 或整體存活期 (Overall Survival, OS) 皆呈顯著延長,並且與治療匹配度更高。高(≥50%)與低(<50%)匹配評分治療亦與延長 PFS 及與 OS ,以及達到更高的 ≥6 個月疾病穩定、部分緩解以及完全緩解率(高匹配度與低匹配度之三者總和差異為 52.1% vs 30.4% ;P < 0.001)等各臨床指標達到相關性。結論來說,接受 MTB 建議治療的病患能與其基因變異匹配得更好,而且治療與基因變異匹配程度是有效改善腫瘤治療結果(包括整體存活率)的獨立預測因素。(請參閱表一)
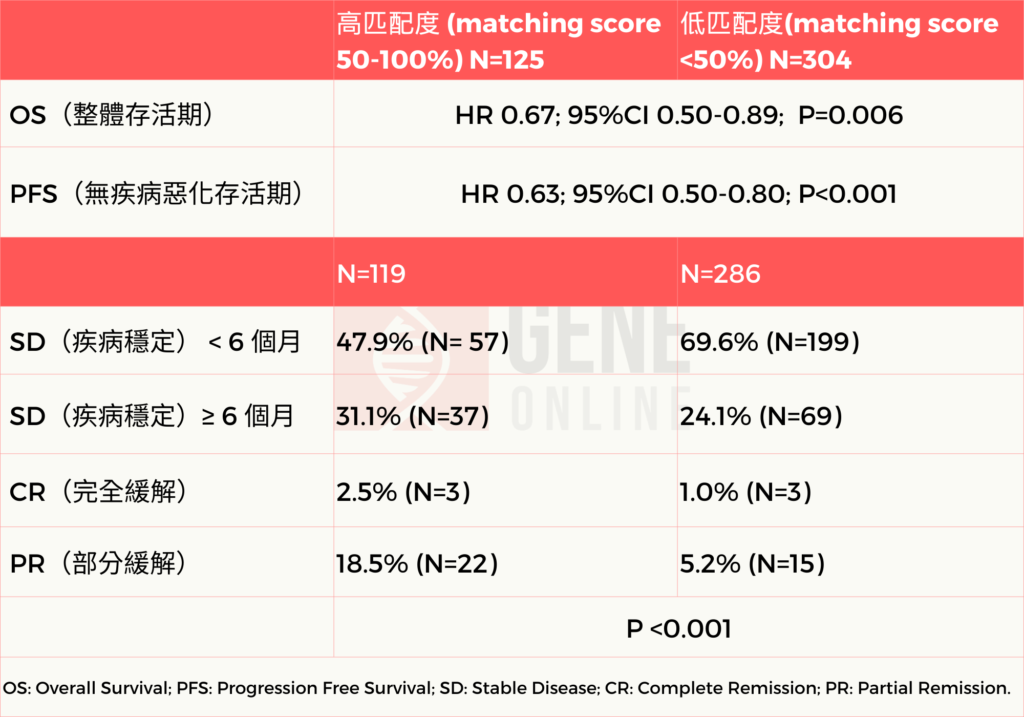
MTB 應用於臨床試驗收案評估
Basse 等人於 2018 年發表文獻中提及高通量分子篩選技術可以識別多項分子變異,其中一些是可以使用分子標靶治療 (molecularly targeted agents, MTA) 治療。這篇文獻主要評估在 Institute Curie Molecular Tumor Board (MTB) 所建議框架內引導癌症病患進行 MTA 臨床試驗的關連性。試驗納入從 2014 年 10 月 4 日至 2017 年 10 月 31 日在 Institute Curie MTB 就診的所有病患。從他們的病例中研究員提取以下訊息:進行腫瘤分析的決定、分子分析的類型、使用的樣本、識別分子變異以及那些可以針對用藥的,並將其納入匹配 MTA 的臨床試驗中。
試驗結果顯示,共 736 名病患參加了 MTB。其中共 442 名病患 (60%) 進行了分子分析。使用的技術包括次世代定序、微陣列等技術為基礎的比較基因組雜交 (comparative genomic hybridization array)。送檢檢體中針對 91 名病患 (21%) 的新鮮冷凍檢體、326 名病患 (74%) 的封存組織(固定或冷凍)以及 25 名病患 (6%) 的封存組織和新鮮冷凍檢體進行了分析。在 280 名病患 (63%) 分析中發現了至少一項分子變異。在 207 名分析病患 (47%) 中發現了可治療的分子變異。 45 名分析病患 (10%) 最後參加了一項與 MTA 匹配的臨床試驗,另外 29 名病患根據 MTB 分析之前確定的分子變異將其納入臨床試驗。樣本接收日期和分析數據結果發布之間的中位數時間為 28 天(範圍:5-168 天)。在這項研究中證明實施 MTB能 使 10% 的病患受惠且納入治療匹配的臨床試驗。
運用 MTB 建立臨床指引(以韓國為例)
由 Yoon 等人於 2022 年所發表的探討文獻提到,由韓國腫瘤學會( Korean Society of Medical Oncology, KSMO)以及韓國癌症研究小組( Korean Cancer Study Group, KCSG) 一起創立的韓國精準醫療網絡小組(Korean Precision Medicine Networking Group, KPMNG),且經由上述學會所建議的腫瘤專家,在韓國病理師學會(Korean Society of Pathologist)病理師以及生物資訊專家的協助下,組成指導委員會及撰寫委員會,且利用精準醫學共同建立不同腫瘤相關的臨床指引。
在建立臨床指引之前,主要參考六個問題,來定義NGS使用於腫瘤的情況,這六個問題已整理如下表:

這些問題將使委員會瞭解 NGS 介入的最佳時機、採樣時該考慮的因素、以及詮釋 NGS 結果時該考慮的因素等,透過 MTB 的從中運作合併 NGS 所獲得的結果最後如何在精準醫療中運用。其中 MTB 如何運作將影響病人是否能得到個人化精準醫療照護尤為關鍵。
文獻中提到,MTB 主旨在於透過專家委員會討論針對晚期實體瘤病患的基因分析結果來量身定制潛在治療的方案。主要討論的重點在:1. NGS 的品質評估;2. 審查在 NGS 檢驗中所發現具有臨床意義的基因異常;以及3. 依據 NGS 的結果提出適當的治療方案。而MTB 討論的結果應統一記錄在規定的報告中,包括病患的基本資料、NGS 結果討論、詮釋的摘要以及最後的建議治療。
至於如何將 NGS 結果應用於精準醫療上,透過該數據在 MTB 的討論中應優先選擇具有與 NGS 確定的分子變異匹配度高且已經過核准的標準治療。
如果 MTB 根據 NGS 結果所建議的藥品尚未獲准使用於特定癌症類型,應將其納入保險給付藥品的範圍,經 6 人或以上的專家委員會審查後,可核准仿單標示外使用(off-label use),這也包括每個機構的腫瘤專家使用,而後可申請韓國 Health Insurance and Review Assessment (HIRA )核准。原則上這些藥品都須事先申請,自專家委員會收到申請之日起 60日內經過審議後通知核准使用。如審查期間需要及時治療的病患,可申請批准後使用( use before approval, 這樣就可以在藥品批准前事先使用)。
此外,如果 MTB 所建議的藥品尚未獲得韓國核准且不符合仿單標示外使用資格,病患可以藉由參與臨床試驗或是申請擴大藥品取得方案(Expanded Access Program)而接受該藥品治療。
整體而言,NGS 在癌症上的運用越來越重要,對專家委員會如 MTB 來說更有助於尋找對病患更精準更有效的治療方案。
結論
至今為止,精準腫瘤醫療試驗一直侷限於預定單一治療與相關分子的匹配,而在匹配過程中,可能出現 5-10% 的低匹配率,而因此降低治療反應率。專家認為低匹配率可能源自使用有限的基因組合、具限制的分子匹配演算、缺乏可用的藥品;或者是在治療期間,癌末病患惡化或死亡。一項名為 I-Predict 的研究,是假設聯合治療中所提出的個人化精準治療將改善難治型惡性腫瘤病患的預後,而進行的一項跨機構前瞻性試驗。試驗中使用腫瘤 DNA 定序並即時建議個人化精準治療,在此項研究中發現,MTB 所訂製的多藥品聯合治療方案可行性高,試驗中有 49% 的病人同意接受個人化精準治療。如果能識別越多的分子變異越可能提高與標靶治療的匹配度,也更明顯的提升疾病控制率,且延長無疾病惡化存活期 (PFS) 以及整體存活期 (OS)。團隊認為,以目前的精準腫瘤臨床試驗模式而言,皆針對單一分子變異匹配單一治療,這試驗結果建議未來可以依據腫瘤的複雜程度以及分子的變異性,透過使用特定的藥品組合以優化療效與安全性,達到更好的預後。
癌症治療已經從沒有標靶的細胞毒性藥物發展為選擇性的基因組合免疫標靶藥物治療,醫院端在面對每位病人的特殊且複雜的病況時,可能無法選擇最適當的治療。因此跨專業團隊聯合診斷與建議有助於選出各病患的最佳治療。在此環境下, MTB 的形成可說是水到渠成,結合各專家,佐以最新的技術,針對罹患腫瘤的病患提出一系列分子變異與多藥品匹配程度高且專門針對病患的精準治療與護理建議,可以提升病患的存活且改善生活品質。
參考資料:
- Tamborero, D., Dienstmann, R., Rachid, M.H. et al. The Molecular Tumor Board Portal supports clinical decisions and automated reporting for precision oncology. Nat Cancer 3, 251–261 (2022). https://doi.org/10.1038/s43018-022-00332-x
- Luchini C, Lawlor RT, Milella M, Scarpa A. Molecular Tumor Boards in Clinical Practice. Trends Cancer. 2020 Sep;6(9):738-744. doi: 10.1016/j.trecan.2020.05.008. Epub 2020 Jun 6. PMID: 32517959. https://pubmed.ncbi.nlm.nih.gov/32517959/
- Krause, A., Stocker, G., Gockel, I. et al. Guideline adherence and implementation of tumor board therapy recommendations for patients with gastrointestinal cancer. J Cancer Res Clin Oncol (2022). https://doi.org/10.1007/s00432-022-03991-6
- Kato S, Kim KH, Lim HJ, Boichard A, Nikanjam M, Weihe E, Kuo DJ, Eskander RN, Goodman A, Galanina N, Fanta PT, Schwab RB, Shatsky R, Plaxe SC, Sharabi A, Stites E, Adashek JJ, Okamura R, Lee S, Lippman SM, Sicklick JK, Kurzrock R. Real-world data from a molecular tumor board demonstrates improved outcomes with a precision N-of-One strategy. Nat Commun. 2020 Oct 2;11(1):4965. doi: 10.1038/s41467-020-18613-3. PMID: 33009371; PMCID: PMC7532150. https://pubmed.ncbi.nlm.nih.gov/33009371/
- Basse C, Morel C, Alt M, Sablin MP, Franck C, Pierron G, Callens C, Melaabi S, Masliah-Planchon J, Bataillon G, Gardrat S, Lavigne M, Bonsang B, Vaflard P, Pons Tostivint E, Dubot C, Loirat D, Marous M, Geiss R, Clément N, Schleiermacher G, Kamoun C, Girard E, Ardin M, Benoist C, Bernard V, Mariani O, Rouzier R, Tresca P, Servois V, Vincent-Salomon A, Bieche I, Le Tourneau C, Kamal M. Relevance of a molecular tumour board (MTB) for patients’ enrolment in clinical trials: experience of the Institut Curie. ESMO Open. 2018 Apr 6;3(3):e000339. doi: 10.1136/esmoopen-2018-000339. PMID: 29636991; PMCID: PMC5890857. https://pubmed.ncbi.nlm.nih.gov/29636991/
- Yoon S, Kim M, Hong YS, Kim HS, Kim ST, Kim J, Yun H, Yoo C, Ahn HK, Kim HS, Lee IH, Kim IH, Park I, Jeong JH, Cheon J, Kim JW, Yun J, Lim SM, Cha Y, Jang SJ, Zang DY, Kim TW, Kang JH, Kim JH. Recommendations for the Use of Next-Generation Sequencing and the Molecular Tumor Board for Patients with Advanced Cancer: A Report from KSMO and KCSG Precision Medicine Networking Group. Cancer Res Treat. 2022 Jan;54(1):1-9. doi: 10.4143/crt.2021.1115. Epub 2021 Dec 13. PMID: 34902959; PMCID: PMC8756119. https://pubmed.ncbi.nlm.nih.gov/34902959/
- Sicklick JK, Kato S, Okamura R, Schwaederle M, Hahn ME, Williams CB, De P, Krie A, Piccioni DE, Miller VA, Ross JS, Benson A, Webster J, Stephens PJ, Lee JJ, Fanta PT, Lippman SM, Leyland-Jones B, Kurzrock R. Molecular profiling of cancer patients enables personalized combination therapy: the I-PREDICT study. Nat Med. 2019 May;25(5):744-750. doi: 10.1038/s41591-019-0407-5. Epub 2019 Apr 22. PMID: 31011206; PMCID: PMC6553618. https://pubmed.ncbi.nlm.nih.gov/31011206/
- http://www.tpms.org.tw/IntlVideo_detail.php?ID=6#:~:text=%E5%88%86%E5%AD%90%E8%85%AB%E7%98%A4%E5%A7%94%E5%93%A1%E6%9C%83(MTB)%20%E6%98%AF,%E7%BB%84%E5%AD%B8(Proteinomics)%E7%AD%89%E3%80%82
本文為羅氏大藥廠與基因線上合作專文 (M-TW-00002459)
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com





