多年來,生物製藥市場一直以針對細胞蛋白質的小分子藥物為主。然而,大多數還是無法成功開發進入市場。在近幾十年中,RNA領域的突破性研究推動RNA療法的發展。儘管RNA本身的特性使得在藥物開發過程中多了不少挑戰,但與現有療法相比,它仍具有某些優勢。且讓我們一同回顧 RNA 領域近年來發展及未來展望。
化學藥物治療一直以來都是人類在對抗重大疾病的重要武器。儘管如此,仍然存在一些疾病是尚未找到候選藥物或是無法完全治癒。即使收集了大量關於致病機轉的資料,許多疾病現階段仍然被評為「無藥可醫」。目前市面上大多數美國FDA批准的藥物都是屬於作用於蛋白質(例如酶、激素或受體)的小分子抑製劑,而這僅包含一小部分的細胞蛋白。蛋白藥物(例如抗體)雖然表現出絕佳的特異性,但是卻具有其他重大挑戰,例如分子量龐大和及穩定性不佳。病患個體DNA的差異性大以及抗藥性問題進一步加劇了這些挑戰。綜觀以上問題,對新型生物製劑的需求是從不間斷的。
RNA療法的優勢與劣勢
近幾年對於RNA領域的研究有了開創性的發現,如干擾性RNA以及發現非編碼的RNA。這些研究都進一步促進了運用此大分子來開發新療法。儘管在過去的20年中已經研究了多種RNA治療模式,但迄今為止FDA僅批准了7個藥物(圖1)。
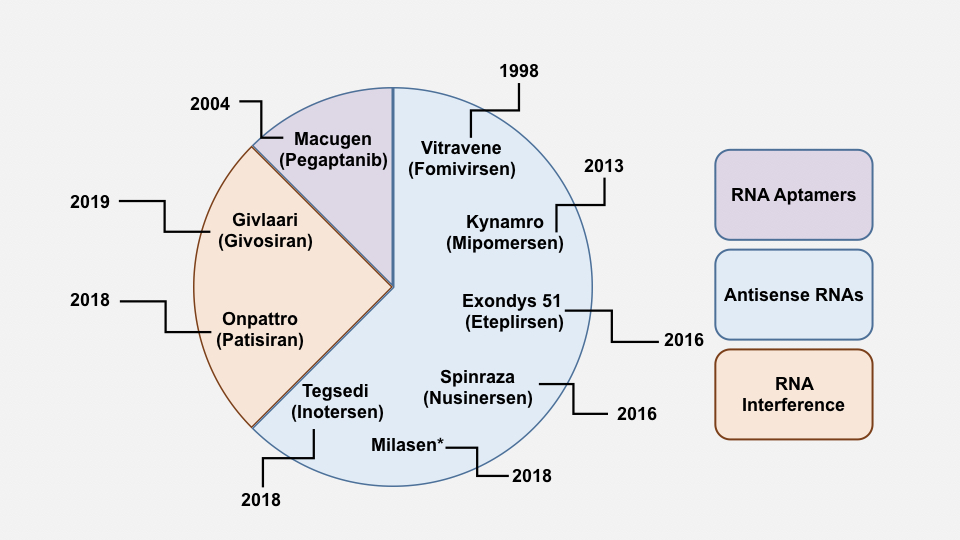
圖1:近年來,FDA批准的RNA療法。 *米拉森(Milasen)是特例,已獲得批准,其中僅用於1位患者。
部分 RNA 藥物優於小分子藥物的特點在於它們可以直接與 mRNA 結合並造成其降解,從而防止致病蛋白質被轉錄。另一個優勢是RNA藥物可以輕易地將其與現有療法合併使用。然而它們並不穩定,容易被核糖核酸酶降解以及免疫原性不佳是主要障礙。另一個艱鉅的任務是找到合適的標的細胞並設計適當的投藥路徑使藥物可以順利通過雙層脂質的細胞膜。以上挑戰若能被克服,與傳統藥物相比,之後開發路程會相對容易許多。
近年來,CRISPR/Cas9 技術的進展突飛猛進,將 RNA 藥物開發提升到了一個新的境界。現在可以藉由誘導染色體突變來改變病患基因的表達。CRISPR/Cas9 技術才剛剛開始涉足 RNA 編輯,而能做到的事情遠遠超出超出了過往的進展。讓我們看一下過去幾十年來其他一些RNA藥物的開發歷程(圖2)。
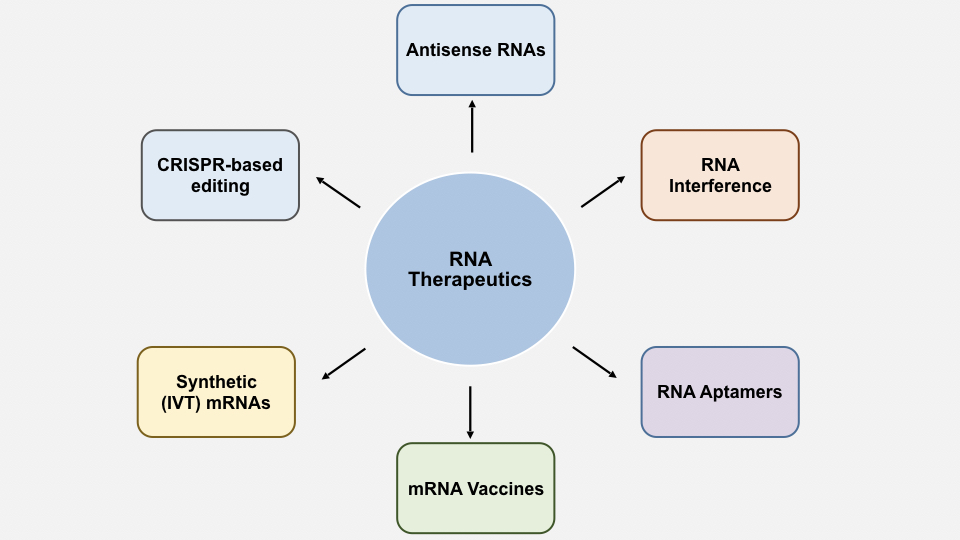
圖2:目前以上市的不同類別RNA藥物
反義RNA藥物
反義寡核苷酸(antisense oligonucleotide, ASO)的藥物原理是與靶標mRNA互補鹼基配對,也因此成為有吸引力的待開發潛力治療選擇。這個想法源自於1978年,當時設計了一種特定的寡脫氧核糖核苷酸(oligodeoxyribonucleotide)用來抑制肉瘤病毒(Rous sarcoma virus)的RNA轉譯。為了解決核糖核酸酶(ribonucleases)等諸多影響,ASO經過許多化學修飾。在鹼基、糖基、核苷間鏈結的修飾或大、小大分子偶聯等使用皆明顯改善了藥代動力學、穩定性、結合親和力以及效力。一些常見的修飾包括2′-O-甲基,2′-氟,5-甲基胞嘧啶和2′-O-甲氧基乙基等取代基。
Ionis Pharmaceuticals獨領風騷
2016年,Exondys 51 和 Spinraza 兩個 ASO 藥物獲得FDA的批准,為市場首開先路。Sarepta Therapeutics 開發的Exondys 51(Eteplirsen)可用於治療因肌縮蛋白(dystrophin)基因突變所造成的裘馨氏肌肉失養症(Duchenne Muscular Dystrophy, DMD)並獲得快速審查。此ASO含有二氨基磷酸酯嗎啉基修飾(phosphorodiamidate morpholino modification),可以透過在pre-mRNA splicing時驅動exon 51的切除,修正下游肌縮蛋白的讀取區以治療疾病。同樣的,Spinraza(Nusinersen)也改變了RNA剪切(RNA splicing),來治療由SMN1基因變異或同型合子缺失所引起的脊髓性肌萎縮症(Spinal Muscular Atrophy, SMA)。它具有兩個修飾:2′-O-甲氧基乙基取代(2’-O-methoxyethyl substitution)和硫代磷酸鹽鍵結(phosphorothioate linkage)進而降低親水性、增加穩定性並增強蛋白質結合能力,這些條件對於細胞攝取和細胞內的分佈至關重要。該藥物最初由馬薩諸塞大學醫學院 (UMass Medical School) 的 Dr. Ravindra Singh團隊所發現,授權給 Ionis Pharmaceuticals(以前稱Isis Pharmaceuticals)與冷泉港實驗室的 Adrian Krainer 教授合作開發藥物化合物。與Biogen的商業合作讓後者獲得了Spinraza開發和商業化的擁有權。
Ionis Pharmaceutical 的 Tegsedi(Inotersen)去年獲得FDA的批准,用於治療遺傳性甲狀腺素調控的類澱粉變性(hereditary transthyretin-mediated amyloidosis, hATTR)引起的多發性神經病變(polyneuropathy)。此ASO藥物具有許多修飾包含:2′-O-甲氧基乙基,5-甲基尿嘧啶,5-甲基胞嘧啶,鈉鹽和硫代磷酸鹽鍵。去年,Ionis及其子公司 Akcea Therapeutics 的另一個 ASO 藥物─Waylivra(Volanesorsen)因安全性考量上在FDA踢到了鐵板。然而,今年5月卻獲得了歐盟的批准,用於治療家族性乳糜微粒血症(Familial Chylomicronemia Syndrome, FCS)的成年患者。顯著的臨床試驗數據和歐盟的批准讓其決定再次嘗試申請美國的授權。時至今日,Ionis具有75.7億美元的市值,多元化的產品線使其在臨床試驗的各個階段都擁有各類型頂尖的藥物,可治療多種疾病,包括癌症,心血管疾病,神經疾病,感染性疾病和肺部疾病。
ASO藥物與個人化醫療
去年有個特例,一個ASO藥物─Milasen迅速被開發且通過FDA批准,進而救了一名患者成為個人化醫療的開創性典範。波士頓兒童醫院的 Dr. Timothy Yu和他的同事借鏡Spinraza,設計了一種寡核苷酸,用於治療一位患有巴登氏病 (Batten disease) 的6歲兒童Mila Makovec,巴登氏病是罕見的致命神經退行性疾病。隨後掀起一場為Mila開發藥物的競賽 : 比賽在藥物開發上創紀錄。
RNA干擾藥物
細胞中RNA干擾機制是藉由小的非編碼RNA(例如siRNA和miRNA)經由轉錄或轉錄後靜默基因來控制基因的表達。內源性的miRNA透過有限的互補鹼基配對來識別並結合目標mRNA,進而使其裂解或抑制轉譯;siRNA則是由外源dsRNA製成,並可完美的與mRNA互補結合。這兩類RNA都需要宿主的內源機制來生產製造。在線蟲研究中的重大發現一口氣將RNA的研究推至新的境界,而其作為改變基因表達的功能則持續對其他各個領域造成影響。同時,藥物開發人員開啟了對RNAi的興趣,現在亦有許多siRNA藥物進入了臨床試驗階段。與ASO一樣,RNAi藥物需要修飾以增強效力並且避免過多非特異性結合。Alnylam Therapeutics 是一家知名的RNAi藥物開發公司,成立於2002年,目前市值為99.2億美元。Onpattro(Patisiran)是歷史上第一個被FDA批准的RNAi藥物。Patisiran目前用於治療遺傳性甲狀腺素轉運蛋白澱粉樣變性(hATTR)。11月20日,該公司宣布FDA批准了針對氨基乙酰丙酸合酶1(ALAS1)的 Givlaari(Givosiran),用於治療急性肝性紫質症(AHP)。
Dicerna Therapeutics 是一家規模較小的 RNAi 藥物開發公司,但仍被譽為緊追 Alnylam 以及 Ionis 之後極具潛力的團隊。它已經發明了一種名為 GalXCTM 的新技術,推動下一代 RNAi 治療的開發。以 GalXC 技術為核心的藥物是藉由 Dicer 酶來作用,該酶所引發的 RNA 干擾機制可以靜默引起肝臟疾病的基因的表現。該公司在臨床前和臨床試驗中有許多候選藥物,但其最先進的是治療原發性高草酸尿症的 DCR-PHX,這是一種罕見腎臟疾病,腎臟無法正常發揮功能來過濾掉體內廢物。
延伸閱讀:英 NHS 於 JP Morgan 宣布攜手 Novartis 開發 RNAi 降血脂針劑同樣地,許多 miRNA 擬似物的治療方法正在臨床前開發或早期臨床試驗中。這些藥物模擬內源性的 miRNA 來結合其靶標以誘導基因靜默。普遍上認知內源性 miRNA 的缺失是會導致腫瘤的增殖和發展。於 2017 年,一份研究文獻介紹了 MesomiR-1,這是第一個進入人體臨床一期試驗的載有微小 RNA 的微小細胞(EnGeneIC Dream Vectors),被稱為 TargomiRs。它們是基於 miR-16 的 miRNA 模仿物,以 EGFR 為標靶用於惡性胸膜間皮瘤的臨床前治療模式中。這種新穎的治療方法將如何發展還有待觀察。 Miragen,MiRNA Therapeutics(現為Synlogic)和 Regulus Therapeutics 是一些專門開發 miRNA 藥物的公司。儘管他們中沒有發展到3期臨床試驗的藥物,但已經有許多藥物於2期臨床試驗進行中。
RNA適體(RNA aptamers)
與上述類別不同,RNA 適體是直接作用並阻斷蛋白質產物。它可以通過多次體外或細胞層級的篩選過程所篩出,該過程技術稱為SELEX(systematic evolution of ligands by exponential enrichment)。透過SELEX的過程,可以從RNA庫中挑選出許多獨特的序列來結合蛋白質標的。它們的功能類似於抗體但更容易製造,而小體積的優勢,可與標的蛋白質難以接觸的結合位點相互作用,除此之外更具備較穩定的結構、高耐熱性,並且像其他 RNAi 治劑一樣,可以通過化學方法進行修飾。Macugen(Pegaptanib)是首個獲得FDA批准的適體藥物,用於治療新生血管型老年性黃斑部病變(neovascular age-related macular degeneration, AMD)。但它最初的設計是作為治療癌症的anti-VEGF適體。同樣的,許多針對EGFR、HER2、HER3、PD-1/PD-L1、CD-40或核仁素(nucleolin)的適體,已被開發並在臨床試驗中證明其具有抗腫瘤特性。目前,補體C5抑製劑Zimura(avacincaptad pegol)正在臨床試驗階段,試驗與 Lucentis 聯合治療AMD。
mRNA治療:合成(IVT)mRNA和疫苗
體外轉錄(In vitro-transcribed, IVT)的合成 mRNA 是一類新興的RNA治療藥物,其中導入細胞的mRNA分子可以產生出具有功能的蛋白質。早在1990年代,Wolf等人就已經證明了宿主細胞的蛋白質合成機制可以轉錄體外合成的 mRNA 以生成新的蛋白質。它可以是抗體、蛋白抗原、細胞激素或基因編輯蛋白。但僅在優化mRNA穩定性和轉譯效率後,這個概念才受到關注。就像內源性mRNA一樣,體外合成的mRNA模板必須包含優化的結構,例如5’cap、5’UTR、編碼序列、3’UTR和polyA尾端,以提高功效並防止不樂見的免疫原性反應。然而,它們的免疫原性是有利體外合成mRNA被開發為疫苗的一項特性。與傳統疫苗相比,mRNA具有強效且穩定持久的品質。此外,它們可大量生產且容易引發類似於病毒感染的免疫反應是非常大的優勢。目前,許多mRNA疫苗正在進行人體臨床試驗,mRNA治療劑和疫苗開發的先驅—Moderna Therapeutics 目前也已經有不少藥物正在開發階段。 今年9月,它宣布與哈佛大學長期合作,即將在哈佛醫學院建立調節免疫系統的RNA治療聯盟(ARTiMIS),該聯盟將利用mRNA平台和奈米顆粒遞送技術增進免疫學領域的研究。
RNAi治療的未來與挑戰
除了不良的藥物動力學、穩定性和非特異性結合外,某些RNA藥物(尤其是ASO和siRNA療法)的主要缺點是細胞吸收率差。RNA藥物必須通過脂雙層,透過胞吞作用進入細胞。並且經過核內體逃脫(endosomal escape)才能到達細胞質。RNA必須用陽離子脂質或其他類型的奈米粒子進行轉染,在物理層面才能保護RNA免於被降解,並促進細胞吸收和核內體逃脫。然而這種方法並不保證安全,因為脂質奈米粒子會引起肝臟毒性。另一方法是將RNA與目標配體結合,比如N-乙酰半乳糖胺(GalNAc)。GalNAc是一種氨基糖,由於其受體在肝細胞表面高度表達,有助於將RNA有效地靶向肝臟細胞。RNA治療的新領域正穩健發展,儘管目前為止只批准了少數幾種RNA藥物,但仍鼓舞了其餘尚在臨床試驗階段的藥物。可以肯定的是,未來幾年RNA治療將在藥物研究中佔有一席之地,降低尚無相對應藥物治療的蛋白質標的並治癒疾病。
撰文 / Rajaneesh K Gopinath
翻譯 / Rayean Wu
【本文同步刊載於基因專刊DEC 2019期,更多精彩報導請鎖定基因線上】
References
1. https://www.ncbi.nlm.nih.gov/pubmed/29617640
2. https://www.ncbi.nlm.nih.gov/pubmed/30521885
3. https://www.ncbi.nlm.nih.gov/pubmed/29662218
4. https://www.ncbi.nlm.nih.gov/pubmed/31597037
5. http://investors.alnylam.com/news-releases/news-release-details/alnylam-announces-first-ever-fda-approval-rnai-therapeutic
6. http://investors.alnylam.com/news-releases/news-release-details/alnylam-announces-approval-givlaaritm-givosiran-us-food-and-drug
7. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5835633/
8. https://www.ncbi.nlm.nih.gov/pubmed/1690918
9. https://www.ncbi.nlm.nih.gov/pubmed/30795778
10. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6453554/
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com