癌細胞以改變基因與分子訊號方式獲得異常存活能力,可以加速生長、破壞正常組織、誘導血管供給、逃脫凋亡、免疫等清除過程,目前的標靶藥物多以阻斷異常訊號為抑癌手段,例如艾瑞莎、截克瘤、癌思停等,除了阻斷癌細胞異常訊號通路,還有另一個抑癌武器,以癌症代謝作用為治療標的,在近年開始獲得關注,其學理基礎源自於癌症研究領域著名的 Warburg effect 理論,將近百年前諾貝爾生理醫學獎得主 Otto Heinrich Warburg 發現癌細胞利用氧與糖解作用生產能量的方式,與正常細胞截然不同,從此開啟癌症代謝作用研究的大門。
T 細胞代謝途徑研究新發現,有望為免疫學研究開拓新路(基因線上國際版)持續進化中的癌症代謝理論與應用
以往認為癌細胞為了維持快速地生長與分裂,能量與營養補給是癌細胞每日都要煩惱的柴米油鹽。除了能量,癌細胞還必須大量消耗核酸、胺基酸等基礎構建細胞的材料。科學家也圍繞這個概念,發展出各種標記與殺傷腫瘤細胞的方法。目前對癌細胞代謝原理的研究以及在癌症醫療領域的應用已相當成熟且常見,例如以氟-18 去氧葡萄糖腫瘤正子斷層(FDG-PET)篩檢癌症,或是以剝奪核酸材料誘發 DNA 損傷的 5-氟尿嘧啶(fluorouracil,5-FU)作為多種轉移癌第一線用藥,皆可視為基於癌症代謝作用理論所發展出的癌症相關檢測與療法。
受到腫瘤微環境(Tumor microenvironment)概念啟發,目前癌症代謝研究早已不限於癌細胞內部作用,周邊組織中的氧氣、金屬離子、營養分子、血管上皮、血液、纖維母細胞、微生物等,無一不影響癌細胞的生長策略。腫瘤微環境理論亦認為微環境可塑造腫瘤代謝與分子訊號,複雜的生理調控機制使抗癌藥發展趨勢由單一用藥轉向多藥聯用治療。因此目前臨床研究的代謝藥物中,雖然也有少數單一使用的試驗設計,但多數是以常規化療藥物協同代謝標靶治療,從而達到增強對癌細胞殺傷效果。
近年來重新活化免疫系統在癌症治療上獲得突破性勝利,因此腫瘤免疫學研究受到重視,發現重要癌症免疫開關的 James P. Allison 與本庶佑(Tasuku Honjo)也因此獲得諾貝爾生理醫學獎。目前已知腫瘤微環境中的營養分子也會參與調節免疫細胞作用,因此癌症代謝藥物的臨床試驗研究中,亦有不少與免疫檢查點抑制劑聯用的治療策略,冀希由內外部夾攻打擊消滅癌細胞。
2023 年美國癌症研究協會(American Association for Cancer Research,AACR)年會於四月底落幕,主要研討會中就有結合免疫代謝與腫瘤微環境的討論主題(Immunometabolism in the Tumor Microenvironment)。由於各種代謝作用影響範圍廣泛,因此與癌症代謝相關研究還可見於各子項研討會中,例如訊號通路、診斷與癒後預測、放射治療、癌症演化等。
北極星藥業:唯一長期投入臨床癌症代謝療法的台灣代表
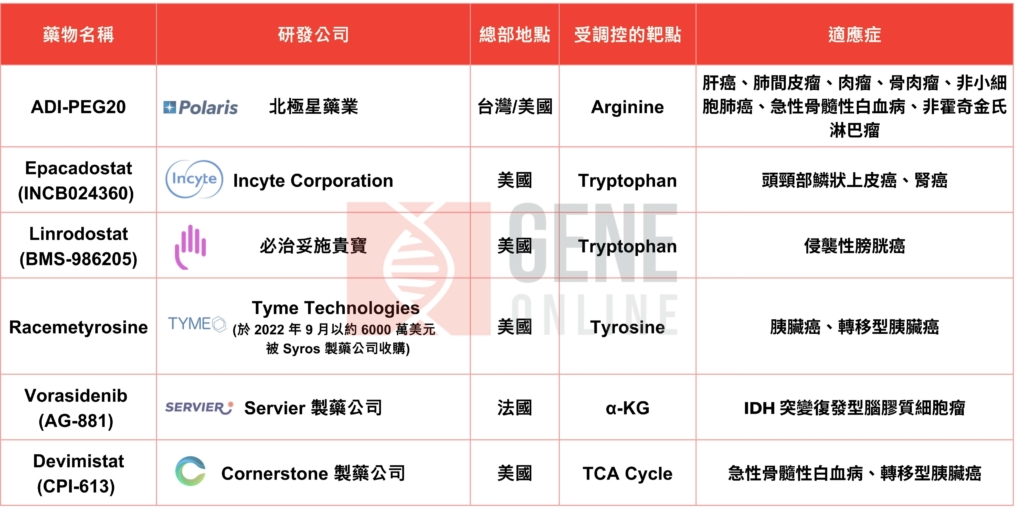
進入臨床研究階段的癌症代謝藥物中,ADI-PEG20 是唯一由台灣生技公司 — 北極星藥業(Polaris pharmaceuticals)研發的藥物,亦是全球第一個結合靶向精氨酸代謝與鉑類化學藥物的偕同療法(Synergistic therapy)試驗。ADI-PEG20 為聚乙二醇(polyethylene glycol,PEG)修飾精氨酸酶,利用特定癌種細胞缺乏自行合成精氨酸特性,分解減少患者體內精氨酸,藉此誘發癌細胞週期停滯、凋亡或自噬作用,而正常細胞因可自行合成精氨酸不受剝奪療法影響。動物試驗中 ADI-PEG20 除了可增加腦癌細胞對放射線的敏感性,還可促使巨噬細胞進入腦瘤組織,並對抗腫瘤細胞。
根據北極星藥業發表於 AACR 的 Clinical Trials Plenary Session 會議報告,名為 ATOMIC-Meso 的第 2/3 期臨床研究中,共有 249 名侵襲性非上皮細胞型胸腔惡性間皮細胞瘤(non-epithelioid pleural mesothelioma)患者參與試驗。在同樣接受葉酸拮抗劑與鉑類化學治療下,以等比例分入 ADI-PEG20 與安慰劑組,結果顯示 ADI-PEG20 可以顯著延長受試者的中位數存活期,ADI-PEG20 與安慰劑組分別為 9.3 與 7.7 個月(95% confidence interval [CI], 7.9-11.8/6.1-9.5),ADI-PEG20 組的死亡風險值降低 29%(hazard ratio [HR] for death, 0.71; p = 0.023),中位數無進展存活期分別為 6.2 與 5.9 個月(95% CI, 5.8-7.4/4.1-5.9; HR 0.65 [95% CI, 0.46-0.90]; p = 0.019),進展風險值降低 35%。1 年總存活率分析顯示,接受 ADI-PEG20 治療較安慰劑多 10%(41.4 vs. 31.4%) 。安全性觀察發現,受試者對 ADI-PEG20 呈現良好耐受性,因治療副作用中斷試驗治療的兩組患者人數接近,在 ADI-PEG20 與安慰劑組分別為 20 與 13.7%,並且與過往試驗相比,沒有發現新的安全性問題。
在美國 clinicaltrials.gov 臨床試驗註冊資料庫披露的資訊所示,ADI-PEG20 正在進行以急性骨髓性白血病、肝癌、非小細胞肺癌、腦膠質母細胞瘤、軟組織肉瘤為適應症的臨床試驗,試驗設計包括靶向特定基因族群、免疫檢查點藥物或放射線治療聯用等,期望未來能找出適合精氨酸剝奪療法的癌症族群。
ADI-PEG20 的二期與三期的全球臨床試驗進展
目前 ADI-PEG20 尚有兩個臨床 3 期試驗正在進行,以肝癌和軟組織肉瘤為適應症,分別在台灣與美國收案,在台灣進行的肝癌試驗,於去年六月於林口長庚醫院納入第一位受試者,預計於 2024 年解盲。回顧軟組織肉瘤的第 2 期試驗,參與試驗醫院包括美國華盛頓、史丹佛、哥倫比亞大學醫學院與南加州大學癌症中心,研究亦獲得美國國家衛生研究院補助,目前正在招募患者的第 3 期試驗,更進一步精準針對軟組織肉瘤中的侵犯或轉移型平滑肌肉瘤(Leiomyosarcoma) 為適應症,預計於今年六月啟動。
目前已核准之代謝療法藥物- 新的癌症代謝療法有望迎來成熟階段
美國 FDA 已於 2017、2019 與 2021 年批准與能量代謝相關的三羧酸循環(tricarboxylic acid cycle,TCA cycle)酵素 isocitrate dehydrogenase(IDH)抑制劑 enasidenib 和 ivosidenib,作為帶有 IDH1 基因突變的急性骨髓性白血病(acute myeloid leukemia,AML) 與膽道癌(cholangiocarcinoma)患者治療藥物。
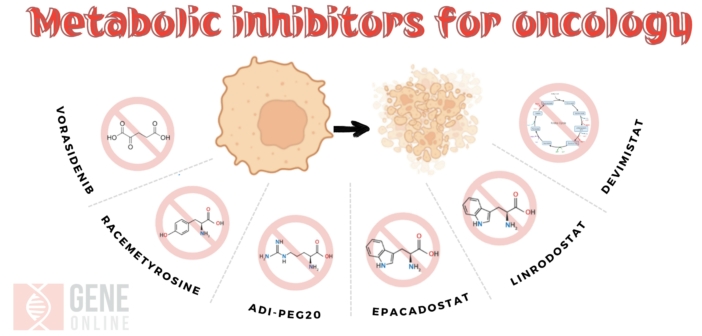
而目前癌症代謝作用的各期臨床研究中藥物,靶向營養代謝路徑還包括葡萄糖(Glucose)、乳酸(Lactate)、麩醯胺酸(Glutamine)、天門冬胺酸(Aspartate)、精胺酸(Arginine)、酪氨酸(Tyrosine)、色胺酸(Tryptophan)、脂肪酸(fatty acid)等。
在今年 AACR 大會中也公布幾項備受矚目的突破性癌症代謝藥物的臨床試驗,包括靶向 IDH 的 LY3410738(Lilly Oncology)、以 Glutamine 為目標的 DRP-104 (Dracen Pharmaceuticals)、針對檸檬酸循環的 CPI-613(Cornerstone Pharmaceuticals),此外,北極星藥業旗下標靶分解 Arginine 的 ADI-PEG20 也是其中之一。
參考資料:
1. https://www.jci.org/articles/view/148550
2. https://www.aacr.org/meeting/aacr-annual-meeting-2023/meeting-resources/
3. https://www.abstractsonline.com/pp8/#!/10828/presentation/10248
4. https://clinicaltrials.gov/ct2/results?cond=&term=+ADI-PEG20&cntry=&state=&city=&dist=
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com