文 / Jane Weng
基因編輯技術對於近代醫療及科學研究的進步有極大貢獻。從發現DNA的雙螺旋構造到擁有人工合成核酸等技術,科學家為了解開基因存在的意義,嘗試了許多種基因編輯技術,希望藉著分析各個基因的機能,了解人類疾病的病因並且做為未來治療的方法。
在現在廣泛被應用的研究技術當中,可以很容易的在培養細胞上強制表現 (Overexpression) 或抑制 (Suppression) 某個特定基因。但是在培養皿中觀察到的現象多半與體內的生理狀態大有差異,尤其是使用 siRNA 或 shRNA 的基因抑制 (gene suppression) 實驗更容易有脫靶 (off-target) 效應的問題。若想要在實驗動物的基因體上將某個基因剔除 (Knockout),傳統的方式需要一定程度的經費與時間。
為了能夠更精準快速地調控基因,近年來,科學家們不斷的開發新的基因編輯技術,例如 Zinc finger nuclease (ZFN) 或是 TALEN (Transcription activator-like effector nuclease) 便是能夠準確切斷目標雙鏈 DNA 的核酸酶。然而,這兩種方法卻因為合成的難度與費用昂貴,難以達到普及。
CRISPR-cas9 帶領基因編輯技術進入新時代
CRISPR 序列是細菌獨有的適應性免疫系統 (Adaptive immunity),原本被發現於細菌的 CRISPR 基因座上(CRISPR loci),細菌被感染時,他們利用自己獨有的 CRISPR 免疫系統,將外來 DNA 截斷並記憶於 CRISPR 序列與序列之間,當再次被感染時,細菌便能即時辨識並誘導 Cas 核酸酶 (Endonuclease) 剪斷目標,避免細菌再度被感染。
在 2013 年,美國 Broad Institute 的 Zhang 團隊與哈佛大學的 Church 團隊同時發表:CRISPR-cas9 系統也可以作用於真核生物 (Eukaryotes) 的基因體中,切斷目標的基因。而現今的 CRISPR-cas9 也成為普遍的基因編輯工具:研究者只需要利用搭載有 CRISPR 序列以及 Cas9 核酸酶的 plasmid,並設計自己想要剔除的目標基因的序列作為 guide RNA 序列 (guide DNA sequence) 放入其中,再導入於培養細胞或實驗動物的受精卵中,便能夠將目標基因切斷而達到抑制基因表現的目的 。加上真核生物 (Eukaryotes) 本身並沒有 CRISPR-cas9 系統,因此對於內生的傳導途徑 (Endogenous pathways) 也比較不會有影響。基於種種優點,CRISPR-cas9 技術已經普遍使用於各種研究領域,不單是基礎科學及藥物目標篩檢,未來也希望能夠應用在臨床醫療上。
CRISPR-cas9 的限制
CRISPR-cas9 雖然有許多優點,卻仍然有許多使用上的限制。
(1) Cas9 核酸酶是透過辨認基因上的一組三核甘酸 – Protospacer Adjacent Motif(PAM)來鎖定目標的,而 Cas9 核酸酶所能辨認的三核甘酸必須是 Guanine-rich (鳥嘌呤) 的部位,這個限制會讓目標切點的選擇減少。
(2) Cas9核酸酶切割雙股DNA會產生平滑末端(Blunt end) 的形式,再藉由同源重組修復系統(Homologous recombination, HR)或非同元的黏合系統(Non-homologous end-joining, NHEJ)的方式修復DNA。利用細胞的修復機制可以將欲編輯的序列趁機編入,達成基因編輯的目的,但是Blunt-end的基因編輯卻較為困難。
(3) Cas9核酸酶的切點靠近作為辨識的三核甘酸(PAM),所以Cas9很可能將PAM一起切除,讓第二階段的應用無法實行。
也因為這些原因,研究CRISPR系統的專家們也極力探索解決的方法,並同時開發其他同樣具有基因編輯能力的核酸酶。
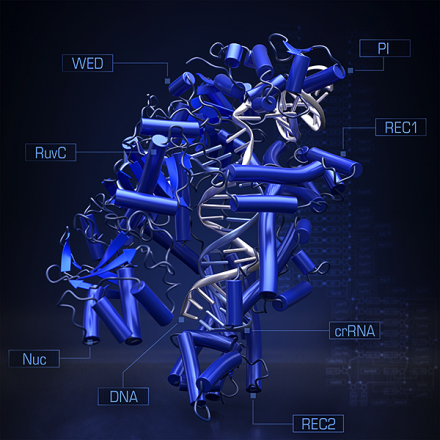
圖為 CRISPR-Cpf1 與 guide-RNA, target-DNA 的結晶體
CRISPR 的新剪刀:Cpf1
2015 年,發現 CRISPR-cas9 具有剪輯真核生物功能的 Zhang 團隊發現了與 Cas9 同類的核酸酶: Cpf1。
Cpf1 與 Cas9 相同,也是 RNA-guided 核酸酶。不同於 Cas9 需要兩個 RNA 序列,Cpf1 只需要guided-RNA 一個序列。Cpf1 同樣有辨認基因用的三核甘酸 (PAM),相較於 Cas9 的 G-rich PAM,Cpf1 的 PAM 以 Thymidine (胸腺嘧啶)為主,這個差異可以讓使用者有較多元的選擇,依照自己想編輯的基因挑選適當的核酸酶。而且,Cpf1 的 PAM 離它切點有一段距離,讓第二階段的調控更簡單。
Cpf1 最主要的優點在於它的 DNA 切斷方式會產生黏狀末端 (Sticky end),讓接下來的基因插入或編輯更加準確(Zetsche et al., 2015)。雖然 Cpf1 作為研究工具還無法實際應用,但是目前的研究顯示 Cpf1 的特性與 Cas9 剛好成為互補,只要能更進一步了解 Cpf1 的立體構造,便能夠開發 Cpf1 成為 CRISP R基因編輯技術的新剪刀。
2016 年 4 月,Zhang 研究團隊與日本東京大學的濡木 (Nureki) 教授的研究團隊共同合作,成功地將Cpf1 與 Guide RNA 以及 Target DNA 複合體的構造結晶化 (Yamano et al., 2016)。同時,中國的Zhiwei Huang 研究團隊也公佈了 Cpf1 與 CRISPR-RNA 結合的結晶構造 (Dong et al., 2016)。這項研究成果將讓 CRISPR-cpf1 系統的開發更進一步。多了不同功能的核酸酶,未來的 CRISPR 技術將有可能取代現有傳統的基因調控技術,而臨床上的應用更是指日可待。
圖為Cpf1與Cas9的比較表
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com
延伸閱讀:CRISPR 2.0 可微調的基因修飾技術參考文獻:
1.Hsu et al., 2014, Cell 157, 1262-1278. “Development and Applications of CRISPR-cas9 for genome engineering”.
2.http://www.jst.go.jp/pr/announce/20160422/
3.Zetsche et al., 2015, Cell 163, 759-771. “Cpf1 is a single RNS-guided endonuclease of a class 2 CRISPR-cas system”.
4.Yamano et al., 2016, Cell 165, 949-962. “Crystal structure of Cpf1 in complex with guide RNA and target DNA”.
5.Dong et al., 2016, Nature 532, 522-526. “The crystal structure of Cpf1 in complex with CRISPR RNA”.
圖片來源:
http://www.jst.go.jp/pr/announce/20160422/
http://labiotech.eu/crispr-patent-war-end-discovery-new-editing-protein-cas9/