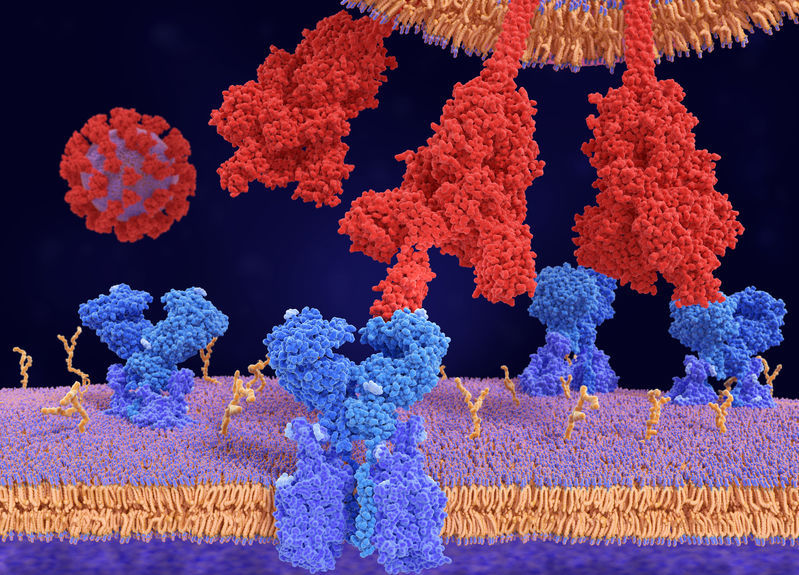
當新型冠狀病毒(SARS-CoV-2)表面的棘狀蛋白(spike protein)與宿主細胞表面受體 ACE2 結合,並在隨後階段催化病毒基因體釋放到細胞中時,感染就開始了。然而,棘狀蛋白與 ACE2 結合的確切機制仍尚待釐清。
近日,由英國法蘭西斯克利克研究中心(Francis Crick Institute)研究團隊於《Nature》刊登一篇 SARS-CoV-2 的研究指出,棘狀蛋白與 ACE2 結合時,能呈現至少 10 種不同的結構狀態,包括未結合且封閉的棘狀三聚體、完全開放的ACE2 結合的三聚體和與 ACE2 結合的解離單體 S1。此結果為新穎的疫苗和治療開發奠定了基礎。
該研究團隊首先培養棘狀蛋白和 ACE2 的混合物,然後藉由在液態乙烷中快速冷凍,捕捉不同形式的棘狀蛋白。再來,他們使用低溫電子顯微鏡觀察這些蛋白樣本,然後獲得數萬張不同結合階段的高解析度圖像。
接著,他們發現棘狀蛋白存在於封閉和開放結構的混合物中。當 ACE2 結合一個開放位點後,棘狀蛋白變得更加開放,導致一系列有利的結構變化,進而為進一步的結合做好準備。一旦棘狀蛋白在所有 3 個結合位點上與 ACE2 結合,它的中央核心就會暴露出來,這有助於 SARS-CoV-2 與細胞膜融合,使得感染得以發生。
延伸閱讀:2 種關鍵蛋白被揪出!協助武漢肺炎病毒入侵人體參考資料:
1. Benton, D.J, et al. Nature (2020). https://doi.org/10.1038/s41586-020-2772-0
2. https://www.technologynetworks.com/tn/news/structural-mechanism-of-coronavirus-receptor-binding-revealed-340572
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com