ATTR 類澱粉沉積症 (ATTR amyloidosis)是一種神經病變疾病,患者因為 TTR 基因突變,導致 TTR 蛋白堆積在組織、器官,初期症狀為周邊神經系統損傷,當蛋白沈積擴散危害心臟,則可能因心臟衰竭死亡。
愛爾蘭公司 Prothena 開發的單株抗體 PRX004 是仍在臨床試驗階段的 ATTR 類澱粉沉積症療法。2021年 7 月 12 日,諾和諾徳藥品(Novo Nordisk)宣佈以 12 億美元收購 Prothena 的全資子公司,且獲得 Prothena 的 ATTR 類澱粉沉積症藥物 PRX004 的所有權利。Prothena 將獲得 1 億美元預付款。
單株抗體 PRX004 療法臨床試驗進程
Prothena 自 2018 年開始 PRX004 的第 1 期臨床試驗,在招募 21 名受試者後,2019 年因疫情因素暫停試驗。但結果已顯示 PRX004 可改善 ATTR 類澱粉沉積症患者神經病變與心臟功能,Prothena 原先預計在第四季度啟動 2/3 期研究。
諾和諾徳收購後將繼續 PRX004 後期臨床試驗,並著重開發 PRX004 對 ATTR 類澱粉沉積症引發心肌病(ATTR-CM)的功效。ATTR 類澱粉沉積症患者因蛋白折疊沈積心臟,使心血管運輸功能阻塞,這類心臟病很少被診斷出來,卻有致死的風險。
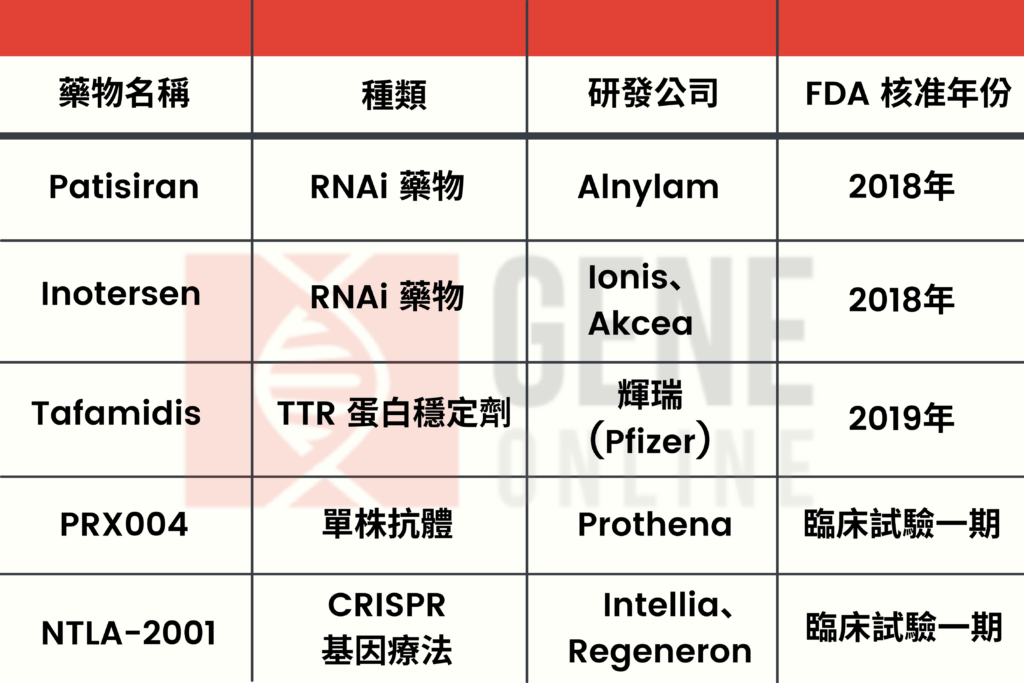
ATTR 類澱粉沉積症現有療法
據統計全球有 45 萬名 ATTR 類澱粉沉積症患者,包含 5 萬名遺傳性 ATTR 類澱粉沉積症患者。即使治療需求廣大,但美國 FDA 加速核准相關療法卻是最近幾年的事。
2018 年 8 月,FDA 首度核准治療遺傳性 ATTR 類澱粉沉積症的 RNAi 藥物 Patisiran (Onpattro) ,Patisiran 由 Alnylam 研發,不僅是 FDA 首度核准的遺傳性 ATTR 類澱粉沉積症藥物,Patisiran 也是第一個獲得 FDA 核准的 RNAi 療法。
同年 10 月, 由 Ionis 與 Akcea 合作開發的 Inotersen(Tegsedi)獲 FDA 核准,也是治療遺傳性 ATTR 類澱粉沉積症的 RNAi 藥物。
2019 年 5 月,FDA 核准輝瑞開發的 Tafamidis(Vyndamax, Vyndaqel),用於治療 ATTR 類澱粉沉積症引發的心肌病。Vyndamax 與 Vyndaqel 分別是治療遺傳型、野生型 ATTR 類澱粉沉積症引發心肌病的口服藥物。
此外,今年 6 月 Intellia Therapeutics 與 Regeneron 進行全球第 1 個 CRISPR 技術的人體臨床試驗,也是以 ATTR 類澱粉沉積症患者為受試對象,治療其突變的肝細胞 TTR 基因,有別於上述治療需要長期給藥,此種療法有望成為一次性 ATTR 類澱粉沉積症治療方式。
ATTR 類澱粉沉積症現有療法
參考資料:
1. https://www.novonordisk.com/content/nncorp/global/en/news-and-media/news-and-ir-materials/news-details.html?id=67562
2. https://my.clevelandclinic.org/health/diseases/17855-amyloidosis-attr
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com





