抗生素雖為許多人的救命丹,但同時也會傷害到腸道菌相,嚴重者甚至可能有發炎或感染艱難梭菌(C. difficile)的風險。除此之外,抗生素的濫用也常會導致細菌產生抗藥性。
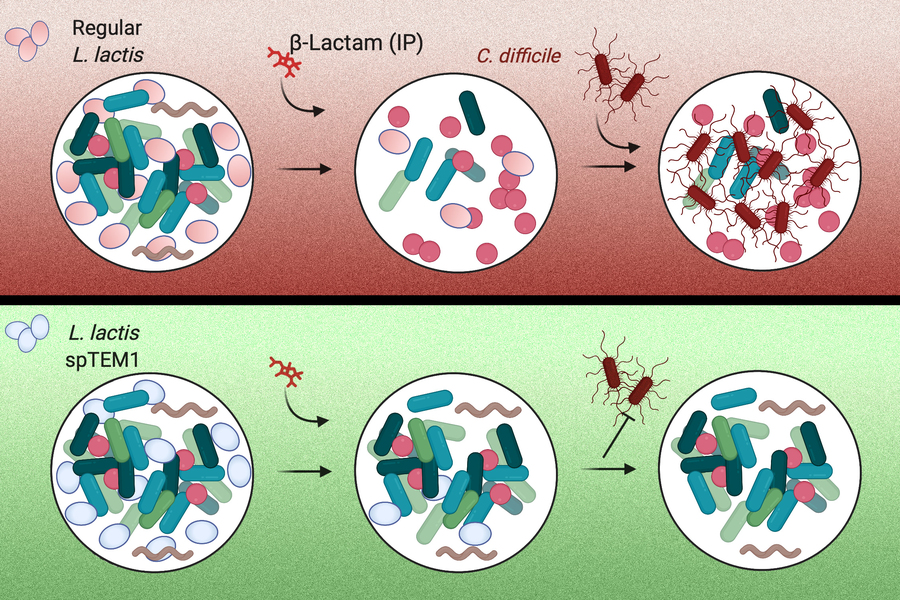
為解決此一難題,美國麻省理工學院(MIT)的工程師成功研發了一種能保護人體消化道內天然菌相的改造細菌。透過改造一種可安全食用的細菌菌株,讓其產生酵素能分解腸道內的 β-內醯胺類抗生素(Beta-lactam antibiotic) 系列抗生素,包含安默西林(Amoxicillin)、安比西林(Ampicillin)和其他常用的抗生素藥物。除了完整守護腸道菌相外,改造細菌株並不會影響到體內血液中抗生素濃度,確保其仍可於其他器官部位產生殺菌效果。此研究日前發布於 Nature Biomedical Engineering 期刊中。
抗生素療程常造成腸道菌相受損
人類腸道中的微生菌相在代謝、免疫功能與神經系統中扮演重要角色,一旦受到藥物或其他飲食因素介入,其組成可能會受到改變或損害,進而導致各種疾病與併發症,其中最常見的為艱難梭菌感染。
艱難梭菌是一種長期存在於人體腸道中,但不會對其造成損害的微生物,不過當與艱難梭菌競爭的菌株受到抗生素攻擊時而消失時,艱難梭菌將可能會主導腸道菌相,進而產生腹瀉與結腸炎。美國每年平均約有 50 萬人受艱難梭菌感染,約 15,000 人因此而死亡。
守護微生菌叢新輔助療法:改造乳酸乳球菌
患者在接受抗生素療程時,醫師常會額外給予益生菌來幫助緩和抗生素對腸道菌所造成的傷害,然而益生菌其實也會受到抗生素的傷害,且其並無法完全還原腸道內的天然菌相。本研究的第一作者 Andres Cubillos 研究員就特別指出,標準的益生菌是無法與原生腸道菌相的多樣性相提並論,也不能發揮相似的功能。
為守護微生菌叢不受抗生素破壞,研究團隊決定改造可食用細菌以研發新輔助療法。透過改造常用於製造乳酪的乳酸乳球菌(Lactococcus lactis),使其可生成能分解 β-內醯胺類抗生素的酵素, β-內醯胺類酶(β-lactamases)。由於 β-內醯胺類抗生素為目前最廣泛使用的抗生素種類,舉凡青黴素(penicillins)、安默西林與安比西林等皆屬於此類,常用於治療與預防細菌感染,因此改造過的細菌輔療可幫助約 60% 服用抗生素療程的患者。
改造過的細菌經口服後會分佈於腸道內,以分解腸道內的抗生素,而抗生素不論是經過口服或注射,仍可在體內血液循環中保持一定的濃度,且當改造細菌完成分解抗生素的工作後,便會從消化道中排出。
切斷細菌內分解酶,避免抗生素抗性基因傳播細菌間
研究團隊在成功研發出改造細菌後,便擔心由 β-內醯胺類酶讓宿主細胞所產生的抗生素抗性基因,將容易在不同細菌之間傳播。
為解決此問題,研究團隊決定使用合成生物學來重新編碼細菌內所合成出的酵素,將 β-內醯胺類酶切成兩片段,使其基因難以轉移至其他細菌上。當細菌於腸道內分泌出酵素片段後,兩片段將會自行組裝以恢復分解的功能,藉此也可避免改造細胞分解抗生素的優勢使其主導天然腸道菌相,進而產生競爭的問題。
維持腸道菌相多樣性,同時保持抗生素療效
在動物實驗中,研究團隊將小鼠分為兩組,其中一組給予改造細菌,並皆施打安比西林。結果發現改造細菌順利抵達小鼠腸道,並開始分泌 β-內醯胺類酶分解抗生素,同時體內的安比西林濃度與未服用改造細菌的小鼠一樣高。
腸道菌相部分,服用過改造細菌的小鼠腸道菌相多樣性比僅施打安比西林的小鼠高,也無任何小鼠受艱難縮菌感染;反之,其中兩隻未服用改造細菌的小鼠在實驗中受到感染,顯示改造細菌能完好的守護腸道菌相,還可同時維持抗生素的濃度與藥效。
本研究的第一作者 Andres Cubilios-Ruiz 強調道:「目前沒有任何療法能像我們的新技術一樣,能利用保護腸道菌相來增加使用抗生素的安全性。」
研究團隊下一步將是持續利用此技術開發新型療法,用於預防任何抗生素療程所帶來的腸道感染,並將於因抗生素引起腸道菌群失衡的急性高風險族群中做測試。
延伸閱讀:《Nature》破解多重抗藥性機制,阻止細菌形成脂多醣外膜!參考資料:
1. Nature Biomedical Engineering, 2022; https://www.nature.com/articles/s41551-022-00871-9
2. https://news.mit.edu/2022/bacteria-good-gut-microbes-antibiotics-0411
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com