基底核(basal ganglia)由紋狀體(corpus striatum)、視丘下核(subthalamic nucleus)、蒼白球(glabus pallidus)以及黑質(substantia nigra)組成,主要功能為自主運動的控制。基底核的病變可導致多種運動和認知障礙,包括帕金森氏病(Parkinsons disease)和亨丁頓氏舞蹈症(Huntington chorea)等。在傳統的基底核功能模型中,連接紋狀體和輸出結構的二條通路以相反的方式運作。第一為直接途徑由直接路徑棘狀投射神經元(direct-pathway spiny projection neurons, dSPNs)上的 D1多巴胺受體活化。第二為間接路徑棘狀投射神經元(indirect-pathway spiny projection neurons, iSPNs)上的 D2 多巴胺受體而抑制。
史丹佛大學霍華德休斯醫學研究所(Howard Hughes Medical Institute of Stanford University)Mark Schnitzer 副教授研究團隊於 5 月 2 日在《Nature》發表一篇文章,指出他們使用螢光內視顯微鏡方法,同時監測小鼠自由行為的活性和群體 dSPNs 和 iSPNs 的空間排列。當鈣進入細胞時,經基因修飾後的二組神經元發出螢光,顯示電子傳遞訊息。
他們首先監測三組小鼠的 dSPNs 和 iSPNs 活動,包含正常小鼠、餵食藥物導致多巴胺釋放神經元喪失以模擬帕金森氏症的小鼠,以及用 L-DOPA (levodopa)誘導多巴胺耗竭進而使小鼠產生不自主運動的組別。結果顯示,在正常動物活動期間中,觀察到 iSPNs 和 dSPNs 有相似的群集大小,而且同時被活化。這些數據與縮放模型(預期在 iSPNs 之前,dSPNs 能活化)和動作選擇模型(其預測抑制性 iSPN 群集,應該大於促進性dSPN群集)相互矛盾。反之,該研究提供越來越多的證據證實這些途徑可能不會規範運動的基本執行,但仍可在高階行為活動中發揮作用,例如透過強化學習動作塑造運動或控制運動活力。
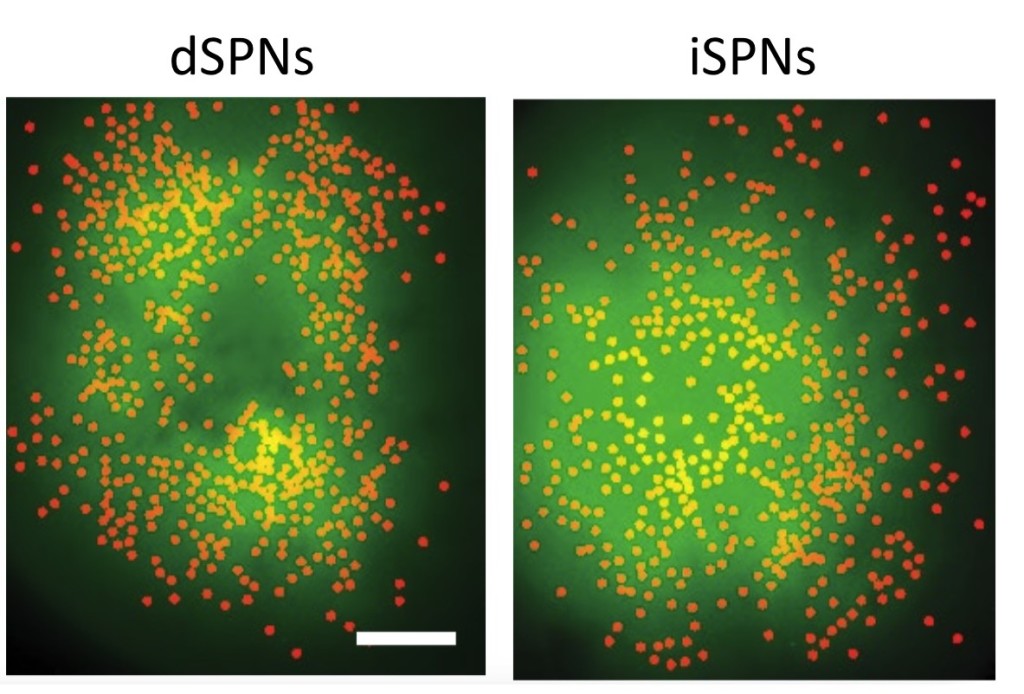
dSPNs 和 iSPNs 螢光顯示。圖來源:Nature (2018) doi:10.1038/s41586-018-0090-6
該研究團隊接著指出,多巴胺耗竭的帕金森氏症動物的 dSPN 活性降低和 iSPN 活性增加,正如常規模型預測的那樣。然而,他們還發現與運動有關的 iSPN 活化隨著時間而下降,以及被活化的空間群集也跟著下降。
該研究團隊也表示,活化 D1 多巴胺受體的藥物增加帕金森氏症小鼠的 dSPN 活性,而且刺激 D2 多巴胺受體的藥物減緩 iSPN 放電率的升高,符合起始預測結果。L-DOPA 導致二種受體的激活,進而引發這二種效應,並且是反轉 iSPNs 中聚集缺陷的唯一治療方法,或許解釋了其優越的臨床功效。最後,由 L- DOPA 造成自主運動能力惡化的動物中,上述藥物的效果會被誇大,例如 iSPN 變得不活躍,並且 dSPN 變得活動過度且聚集較少。
因此,該研究支持早期關於正常、帕金森氏症和運動障礙狀態的活動變化的許多一般性結論。然而,它也顯示傳統模型過於簡化,因為它們不能解釋新發現的疾病狀態的活動紋狀體神經元之空間聚集變化。
控制帕金森病和運動障礙狀態中聚集反常異常的機制尚不清楚,它們是否反映了紋狀體輸入的變化或真正的紋狀體現象仍不清楚。也不知道類似的聚集是否發生在人類或其他靈長類動物中,或者是否伴隨著其他基底神經節結構中神經元活動的聚集改變。
Yerkes國家靈長類動物研究中心科學計劃副主任 Thomas Wichmann 表示,該研究為帕金森氏症提供一個全新治療策略,科學家能以去除超集群紋狀體活動模式和基底核以外的深部腦刺激等方向去研發新藥物。然而,仍有許多問題待未來的研究解決,例如,控制帕金森氏病和運動障礙狀態中聚集反常異常的機制?以及它們是否反應了紋狀體輸入的變化或真正的紋狀體現象?類似的聚集是否發生在人類或其他靈長類動物中?觀察到的基底核中的神經元活動之空間和時間聚集變化是否與帕金森氏症或運動障礙的進展有因果關係等。
延伸閱讀:舞動人生新契機 反義 RNA 新藥有望終結亨丁頓氏舞蹈症參考資料:
1. Trends Neurosci. 1990 Jul;13(7):281-5.
2. Nature . 2018. doi:10.1038/s41586-018-0090-6
3. http://stutter-mind-body.blogspot.tw/2011/06/directindirect-pathways-and-fluency.html
4. https://www.nature.com/articles/d41586-018-02589-8#ref-CR1
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com





