在台灣,惡性腫瘤已高居十大死因首位多年,根據統計,2016 年每十萬人有 203.1 人死於癌症,其中以肺癌、肝癌、大腸直腸癌的死亡人數最多 [1]。而癌症發生率逐年上升,2011 年時每十萬人有 261.1人新診斷罹癌,2015 年時每十萬人有 303.8 人新診斷罹癌,其中發生人數最多之癌別為大腸直腸癌、肺癌及女性乳癌 [2]。
過去癌症治療以化療和標靶治療為主。化療是以藥物去干擾細胞的複製分裂,達到抑制癌細胞生長的作用,但同時也會作用在正常細胞,導致許多副作用如骨髓抑制和落髮 [3]。標靶治療則是以藥物針對促進癌細胞生長的訊息因子傳遞路徑進行抑制,以干擾癌細胞生長,因較具專一性,所以全身性的副作用較低 [4]。
雖然化療藥物和標靶藥物可抑制癌細胞生長,但兩者用於癌症治療的效果,皆僅能維持一段時間。以晚期非小細胞肺腺癌為例,現行一線化療組合的首選為 cisplatin 搭配 pemetrexed,其無疾病惡化時間約 5.1 個月,而平均存活時間為 10.3 個月 [5]。到了二線的化療,使用 docetaxel 僅能帶來 10.6 週疾病無惡化及 7.0 個月的存活時間之效益 [6]。若是帶有表皮生長因子受體 (EGFR) 突變之患者,使用標靶藥物可將無疾病惡化時間延長到 11-13 個月 [7-8]。而在晚期黑色素瘤,使用化療藥品 dacabarzine 的腫瘤客觀反應率僅 15.3%,有效時間僅 5-7 個月 [9],而若是帶有 BRAF V600E 突變之患者,使用標靶藥物可將無疾病惡化時間延長到 9.3-11.4 個月 [10-11]。
人體的免疫系統,能經由 T 細胞辨識外來抗原,進而消滅這些外來物。研究顯示,細胞在分裂的過程,可能會因突變而產生新抗原 [12],其中以黑色素瘤、非小細胞肺癌、膀胱癌、腎細胞癌等癌細胞產生突變的比例較高,所以也帶有較多可被 T 細胞辨識的抗原 [13]。當樹突狀細胞接觸到這些抗原,可經由樹突狀細胞的 B7 和 T 細胞上的 CD-28 結合將 T 細胞活化,進而去辨識癌細胞上的抗原並攻擊 [14]。在一般情形下,T 細胞上的 cytotoxic T-lymphocyte antigen-4 (CTLA-4) 會和 CD-28 競爭與 B7 的結合,減少 T 細胞的活化。此外 T 細胞上帶有 programmed cell death-1 (PD-1),而表皮細胞、內皮細胞上有配體 PD-L1,當兩者結合後,T 細胞的活性會被減弱,這兩者為存在體內之負向調控機制,用來保護 T 細胞造成其他正常細胞之傷害。然而,癌細胞表面也存在 PD-L1,使得 T 細胞無法維持活性,失去消滅癌細胞的能力 [15]。
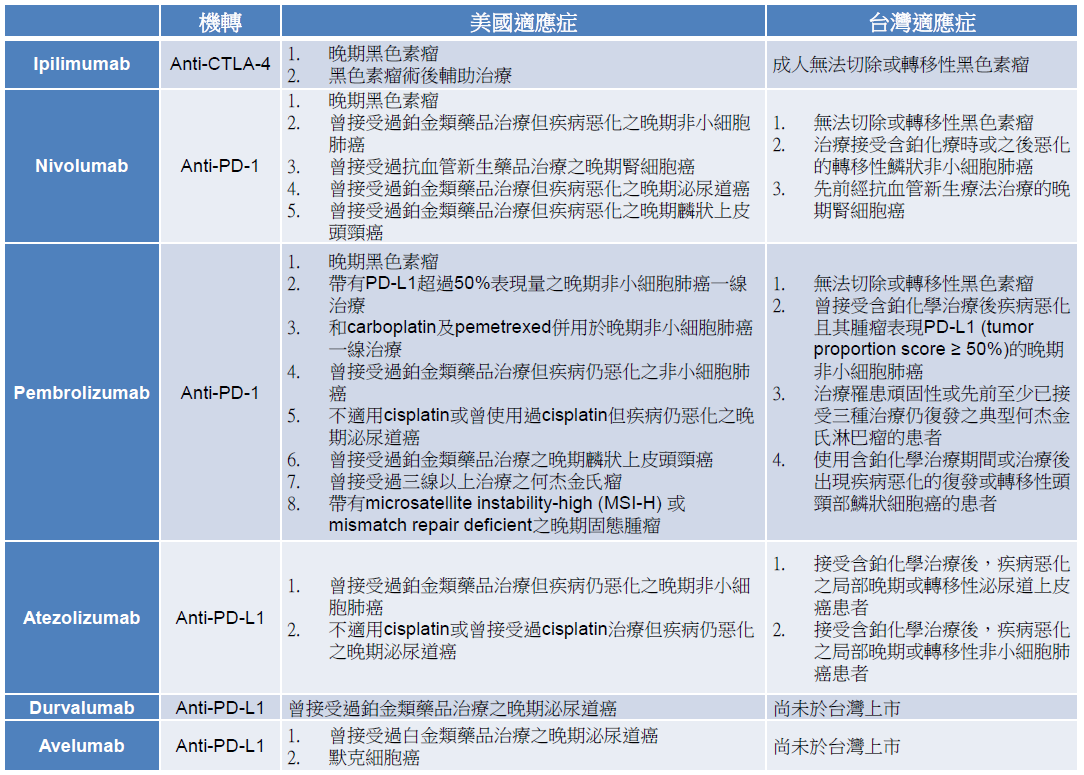
目前已有可調控 T 細胞活性的免疫治療藥品上市,包括作用在 CTLA-4 的 iplimumab、作用在 PD-1 的nivolumab、pembrolizumab,以及作用在 PD-L1 的 atezolumab、durvalumab、avelumab (表一),這類藥品被稱作免疫查核點抑制劑 (immune checkpoint inhibitor)。這些藥品經由阻斷 B7 和 CTLA-4 或 PD-1 和 PD-L1 的結合,可增加 T 細胞活性,為癌症治療帶來新契機。
表一 查核點抑制劑及其適應症
在晚期黑色素瘤方面,ipilimumab 用於二線治療,將存活期延長到 10.1 個月,和 dacarbazine 併用於一線治療,則將存活期增加到 11.2 個月 [16-17]。Nivolumab 用於二線治療,存活期為 16.8 個月,單獨用於一線治療時,無疾病惡化時間為 6.9 個月,和 ipilimumab 併用於一線治療時,無疾病惡化時間更可延長到 11.5 個月 [18-19]。Pembrolizumab 用於一線治療,無疾病惡化時間為 4-5 個月,相較單獨使用 ipilimumab 增加約 2 個月 [20]。而後,這些藥品陸續在非小細胞肺癌、腎細胞癌、泌尿道癌、頭頸癌的臨床試驗,展現了比現行標準治療更優異的療效 (表二) [21-33],尤其在 KEYNOTE-024 這個針對 PD-L1 表現量超過 50% 且未曾接受治療的非小細胞肺癌患者之試驗,pembrolizumab 相較化療可顯著延長無疾病惡化時間 (10.3 vs. 6.0 個月)、六個月存活率 (80.2% vs. 72.4%) 及腫瘤客觀反應率 (44.8% vs. 27.8%),成為第一個可將免疫治療用於晚期肺癌一線治療的適應症 [22]。
表二 查核點抑制劑於主要適應症之療效†
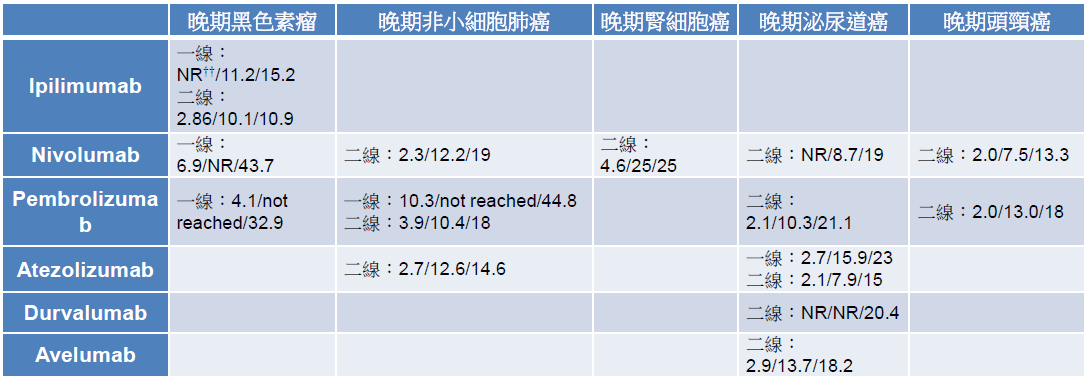 †資料以右列方式呈現:無疾病惡化存活期(月)/總存活期(月)/腫瘤反應率(%)
†資料以右列方式呈現:無疾病惡化存活期(月)/總存活期(月)/腫瘤反應率(%)
††NR: not report
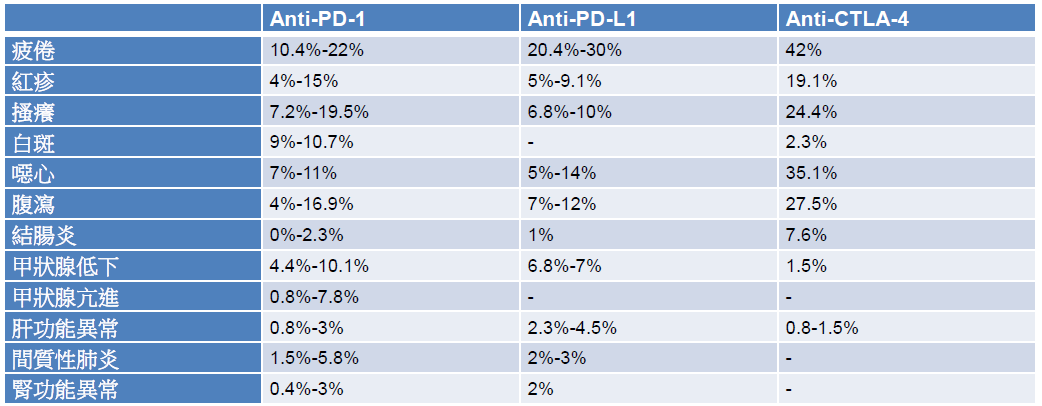
免疫治療雖然不是直接攻擊癌細胞,相較於傳統化療,較沒有骨髓抑制的副作用,但使用上仍有需注意之處。因免疫治療是活化 T 細胞來達到治療目的,在治療過程中,可能產生與免疫相關的不良反應 (immune-related adverse events, irAE),包括紅疹、白斑、結腸炎、腹瀉、甲狀腺功能異常,發生率約 10%-20%,其他可能發生的 irAE 還包括肝功能異常、間質性肺炎、腎功能異常,其發生率約 5% 以下 (表三) [16-33]。irAE 的發生,可能約在開始治療後的一至四個月出現 [34]。在處理通則上,需先排除其他可能的原因,一旦懷疑是 irAE,症狀較輕者 (嚴重程度第一到第二級),可投予局部或較低劑量的全身性類固醇 (prednislolone 0.5-1 mg/kg),症狀較嚴重者 (嚴重程度第三到第四級),可投予較高劑量的類固醇 (prednisolone 1-2 mg/kg),對於結腸炎、肝功能異常或間質性肺炎,若使用類固醇三天後症狀仍無改善,可再加上其他免疫抑制劑,例如 infliximab、mycophenolate [35]。
表三 查核點抑制劑之主要不良反應
在最新的美國癌症治療指引中,免疫治療於多個晚期癌症皆為建議之治療選擇。目前 pembrolizumab、nivolumab和 ipilimumab 已在台灣上市,但因健保尚未給付,臨床使用仍受限制。以 pembrolizumab 為例,其施打方式為每三周一次,一次投予 2 mg/kg 或固定劑量 200 mg,平均每月花費約 17 萬 – 34 萬元,nivolumab 平均每月花費約 22 萬 – 29 萬元,ipilimumab 平均每月花費約 80 萬 – 106 萬元,皆低於美國和日本的價錢 (表四) [36-37]。雖然台灣價錢較國外略低,但對多數病患仍是高額花費,盼中央健保早日納入給付,嘉惠癌症病患。
表四 Nivolumab、pembrolizumab和ipilimumab於台灣、美國、日本之每月費用比較*
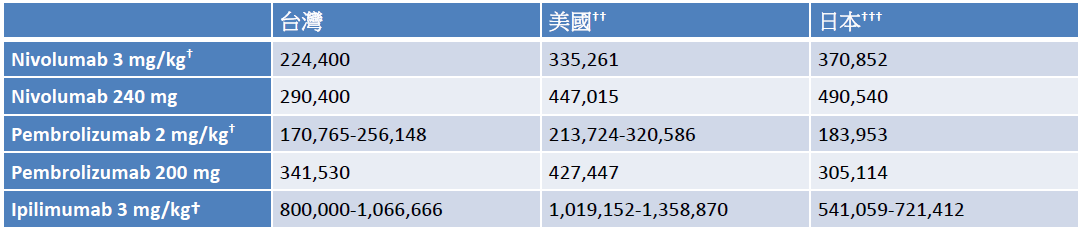 *費用以新台幣呈現
*費用以新台幣呈現
†以體重60公斤計算
††以106年8月14日台灣銀行匯率美金1元=新台幣30.492元計算
†††以106年8月14日台灣銀行匯率日幣1元=新台幣0.2787元計算
雖然免疫治療已為晚期癌症帶來比現行標準治療好的效果,但大家仍在找尋能進一步提升療效的方式。第一,是探討可用來預測治療效果的生物標誌 (biomarkers)。然而,從目前的臨床試驗中發現,除了 pembrolizumab 在非小細胞肺癌的治療外,PD-L1 的表現量與治療效果並無明顯相關性 [38]。第二,是將免疫治療併用其他治療。在KEYNOTE-021 研究中,併用 pembrolizumab 和化療,其腫瘤客觀反應率為 55%,較單獨使用化療增加了 24%,且不限定用於 PD-L1 高表現量者 [39]。在 ECHO-202/KEYNOTE-037 試驗,併用 pembrolizumab 和 epacadostat (IDO-1抑制劑) 來治療晚期非小細胞肺癌,其腫瘤客觀反應率為 35% [40]。而對頭頸癌患者,pembrolizumab 和同步放射線化療併用的效果,也正於臨床試驗評估中 [41]。
免疫治療透過嶄新的抗癌機轉,為癌症治療帶來希望與選擇,相較傳統治療,免疫療法的副作用雖較少,但使用過程中仍需仔細監測相關症狀及檢驗數值。如何提升免疫治療的效果,例如尋找可預測療效的生物標誌或合併其他治療,是當前仍在努力的方向,也是熱門的研究課題。
延伸閱讀:中研院 劉扶東副院長:淺談精準醫學免疫療法治療癌症的可能性撰文 / 郭俊男1,2、張偉嶠2,3
1台北醫學大學 – 台北市立萬芳醫院 藥劑部
2台北醫學大學藥學院藥學系
3台北醫學大學藥學院臨床基因體學暨蛋白質體學碩士學位學程
參考文獻:
- Ministry of Health and Welfare in Taiwan. (Accessed August 15, 2017 at http://www.mohw.gov.tw/cp-16-33598-1.html)
- Taiwan cancer registry. (Accessed August 15, 2017 at http://tcr.cph.ntu.edu.tw/main.php?Page=A5B2)
- Chabner BA. In: L. Brunton, B. Chabner and B. Knollmann eds. Goodman and Gilman’s the Pharmacological Basis of Therapeutics. 12e ed. New York: McGraw-Hill; 2011:1-9
- Sharkey RM and Goldenberg DM. Targeted therapy of cancer: New prospects for antibodies and immunoconjugates. CA Cancer J Clin 2006; 56: 226-43
- Scagliotti GV, Parikh P, von Pawel J, et al. Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer. J Clin Oncol 2008; 26: 3543-51
- Shepherd FA, Dancey J, Ramlau R, et al. Prospective randomized trial of docetaxel versus best supportive care in patients with non-small-cell lung cancer previously treated with platinum-based chemotherapy. J Clin Oncol 2000; 18: 2095-103
- Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol 2011; 12: 735-42
- Sequist LV, Yang JC, Yamamoto N, et al. Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol 2013 20; 31: 3327-34
- Bhatia S, Tykodi SS, Thompson JA. Treatment of metastatic melanoma: an overview. Oncology (Williston Park) 2009 ; 23: 488-96
- Long GV, Stroyakovskiy D, Gogas H, et al. Combined BRAF and MEK inhibition versus BRAF inhibition alone in melanoma. N Engl J Med 2014; 371: 1877-88
- Robert C, Karaszewska B, Schachter J, et al. Improved overall survival in melanoma with combined dabrafenib and trametinib. N Engl J Med 2015; 372: 30-9
- Schumacher TN, Schreiber RD. Neoantigens in cancer immunotherapy. Science 2015; 348: 69-74
- Alexandrov LB, Nik-Zainal S, Wedge DC, et al. Signatures of mutational processes in human cancer. Nature 2013; 500: 415-21
- Chen DS, Mellman I. Oncology meets immunology: the cancer-immunity cycle. Immunity 2013; 39: 1-10
- Dong H, Strome SE, Salomao DR, et al. Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion. Nat Med 2002; 8: 793-800
- Robert C, Thomas L, Bondarenko I, et al. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med 2011; 364: 2517-26
- Hodi FS, O’Day SJ, McDermott DF, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010; 363: 711-23
- Topalian SL, Sznol M, McDermott DF, et al. Survival, durable tumor remission, and long-term safety in patients with advanced melanoma receiving nivolumab. J Clin Oncol 2014; 32: 1020-30
- Larkin J, Chiarion-Sileni V, Gonzalez R, et al. Combined Nivolumab and Ipilimumab or Monotherapy in Untreated Melanoma. N Engl J Med 2015; 373: 23-34
- Robert C, Schachter J, Long GV, et al. Pembrolizumab versus Ipilimumab in Advanced Melanoma. N Engl J Med 2015; 372: 2521-32
- Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med 2015; 373: 1627-39
- Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med 2016; 375: 1823-33
- Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016; 387: 1540-50
- Fehrenbacher L, Spira A, Ballinger M, et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet 2016; 387: 1837-46
- Motzer RJ, Escudier B, McDermott DF, et al. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med 2015; 373: 1803-13
- Sharma P, Retz M, Siefker-Radtke A, et al. Nivolumab in metastatic urothelial carcinoma after platinum therapy (CheckMate 275): a multicentre, single-arm, phase 2 trial. Lancet Oncol 2017; 18: 312-322
- Bellmunt J, de Wit R, Vaughn DJ, et al. Pembrolizumab as Second-Line Therapy for Advanced Urothelial Carcinoma. N Engl J Med 2017; 376: 1015-26
- Balar AV, Galsky MD2, Rosenberg JE, et al. Atezolizumab as first-line treatment in cisplatin-ineligible patients with locally advanced and metastatic urothelial carcinoma: a single-arm, multicentre, phase 2 trial. Lancet 2017; 389: 67-76
- Rosenberg JE, Hoffman-Censits J, Powles T, et al. Atezolizumab in patients with locally advanced and metastatic urothelial carcinoma who have progressed following treatment with platinum-based chemotherapy: a single-arm, multicentre, phase 2 trial. Lancet 2016 ; 387: 1909-20
- Powles T, O’Donnell PH, Massard C, et al. Updated efficacy and tolerability of durvalumab in locally advanced or metastatic urothelial carcinoma. J Clin Oncol 2017; 35: Abstract 286
- Apolo AB, Infante JR, Balmanoukian A, et al. Avelumab, an Anti-Programmed Death-Ligand 1 Antibody, In Patients With Refractory Metastatic Urothelial Carcinoma: Results From a Multicenter, Phase Ib Study. J Clin Oncol 2017; 35: 2117-24
- Ferris RL, Blumenschein G Jr, Fayette J, et al. Nivolumab for Recurrent Squamous-Cell Carcinoma of the Head and Neck. N Engl J Med 2016; 375: 1856-67
- Seiwert TY, Burtness B2, Mehra R, et al. Safety and clinical activity of pembrolizumab for treatment of recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-012): an open-label, multicentre, phase 1b trial. Lancet Oncol 2016; 17: 956-65
- Eigentler TK, Hassel JC, Berking C, et al. Diagnosis, monitoring and management of immune-related adverse drug reactions of anti-PD-1 antibody therapy. Cancer Treat Rev 2016; 45: 7-18
- JHaanen JBAG, Carbonnel F, Robert C, et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017; 28 (Suppl 4): iv119–iv142
- Drug information in UpToDate. (Accessed August 15, 2017, at http://www.uptodate.com)
- Drug information in Kyoto Encyclopedia of Genes and Genomes. (Accessed August 15, 2017, at http://www.kegg.jp)
- Sunshine J, Taube JM. PD-1/PD-L1 inhibitors. Curr Opin Pharmacol 2015; 23: 32-8
- Langer CJ, Gadgeel SM, Borghaei H, et al. Carboplatin and pemetrexed with or without pembrolizumab for advanced, non-squamous non-small-cell lung cancer: a randomised, phase 2 cohort of the open-label KEYNOTE-021 study. Lancet Oncol 2016; 17: 1497-1508
- Gangadhar TC, Schneider BJ, Bauer TM, et al. Efficacy and safety of epacadostat plus pembrolizumab treatment of NSCLC: Preliminary phase I/II results of ECHO-202/KEYNOTE-037. J Clin Oncol 2017; 35(suppl 15): Abstract 9014
- Machiels JPH, Licitra L, Rischin D. KEYNOTE-412: Pembrolizumab (pembro) in combination with chemoradiation versus chemoradiation alone in locally advanced head and neck squamous cell carcinoma (LA-HNSCC). J Clin Oncol 2017; 35(suppl 15): Abstract TPS6090
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com





