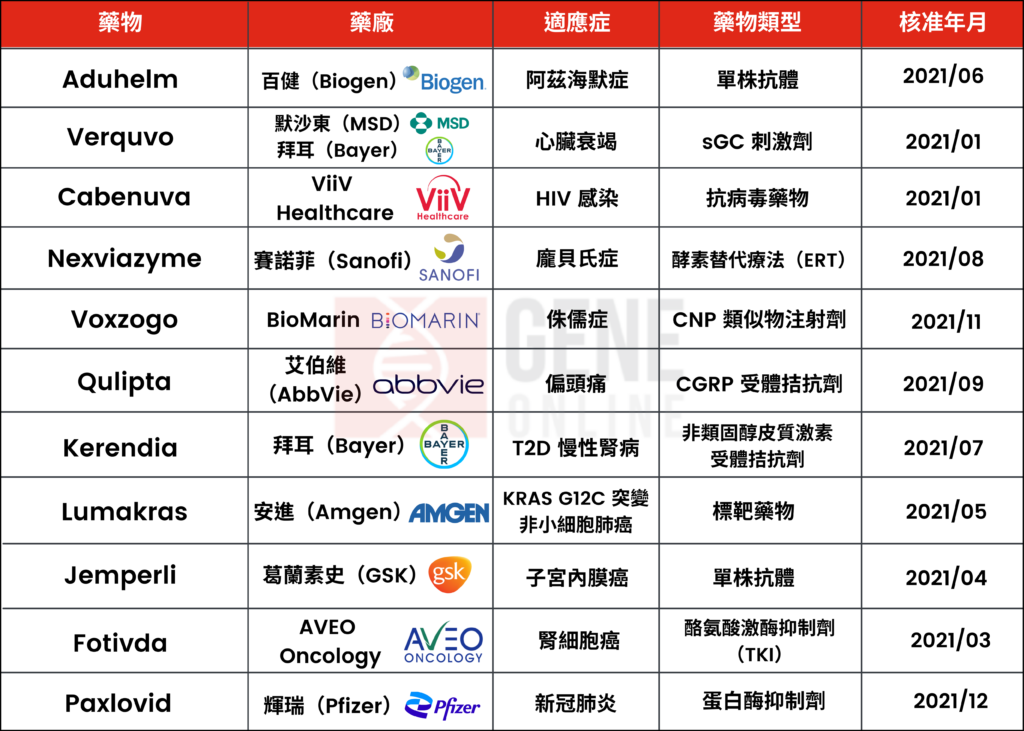
新藥開發與核准是生技製藥產業進展的重要里程碑。基因線上精選 2021 年重大新藥核准事件,帶領讀者回顧過去一年國際新藥研發動態及一探藥物市場未來趨勢。
新藥及生物製劑的開發與核准過程,需要美國食品藥物管理局(FDA)藥物評估及研究中心(Center for Drug Evaluation and Research,CDER)給予支持建議,包括科學、測試及製造程序。
2021 年由 CDER 核准的新分子實體與新治療性生物製劑截至 12 月 23 日共有 50 多項,其中不乏備受市場期待的新藥。此份列表中不包括疫苗、過敏原產品、血液及血液製劑、血漿衍生物、細胞與基因治療產品,其中,癌症療法囊括 16 項。
1. 阿茲海默症新藥問世 Aduhelm 爭議多
今年 6 月,一張阿茲海默症治療新藥許可證,造成醫藥界一片譁然。Aduhelm(aducanumab)是 2003 年以來首支獲准用於治療該病的新療法,也是首個針對該病基礎生理學的療法。aducanumab 是針對類澱粉蛋白的單株抗體藥物,目的是清除大腦內的類澱粉蛋白,以減緩病程。但是,科學界的高度爭議來自於 aducanumab 的 III 期隨機臨床試驗結果尚未定論、臨床改善證據相互矛盾,且針對類澱粉蛋白此一途徑之外仍有許多致病機轉醫界尚未完全瞭解,FDA 卻核准價格高昂、只能帶來邊際效益的藥物。目前醫界普遍認為需要更多有益現實生活與帶來臨床助益的證據。
12 月,歐洲藥品管理局(EMA)正式宣佈拒絕 aducanumab 的上市申請,並指出該藥物清除類澱粉蛋白機制與緩解病情的關聯尚不明確。此外,百健(Biogen)也於同月宣佈 aducanumab 於美國市場價格由每年 56,000 美金下降至 28,000 元美金,定價大幅折半。
詳細報導請點擊2. 心臟衰竭用藥 Verquvo 首支 sGC 刺激劑
每日口服一次的水溶性鳥苷酸環化酶(soluble guanylate cyclase,sGC)刺激劑 Verquvo(vericiguat),是首款用於治療因心臟衰竭住院或需門診靜脈注射利尿劑病人的心臟衰竭藥物。在臨床試驗 VICTORIA 研究中,結果發現vericiguat 可減少有症狀的慢性心臟衰竭且射出分率(ejection fraction)低於 45% 的成人,因心臟衰竭所引起心血管死亡及導致住院的風險。而vericiguat的作用機制與現有心臟衰竭治療方法不同,具特異性恢復有缺陷的 NO-sGC-cGMP 通路,對於曾發生惡化事件的慢性心臟衰竭病人而言,開闢了新的可能性。
詳細報導請點擊3. 首支長效抗 HIV 注射劑 Cabenuva 核准上市
今年年初時FDA便核准每月注射一次的抗 HIV 藥物 Cabenuva(cabotegravir 與 rilpivirine)針劑,作為先前無治療失敗史、且對 cabotegravir 與 rilpivirine 無抗藥性病人的完整治療方案,是第一個完整的抗HIV長效療法。目前常規治療為高效能抗愛滋病毒治療(HAART),又稱雞尾酒療法,合併至少3種抗反轉錄病毒藥物組合。FDA也同時批核口服藥Vocabria(cabotegravir),在接受 Cabenuva 治療前,需口服 cabotegravir 與 Edurant(rilpivirine)1 個月。甚至在COVID-19 大流行期間,在一項臨床試驗 CUSTOMIZE 研究結果中也顯示,Cabenuva 在美國仍獲得病人高度接受及良好的臨床實踐。
詳細報導請點擊4. 龐貝氏症新藥 Nexviazyme 改善步行距離
罕見疾病龐貝氏症(Pompe disease)新藥 Nexviazyme(avalglucosidase alfa-ngpt)注射劑核准用於1歲以上晚發型病患,是繼 Myozyme 和 Lumizyme(成分皆為 alglucosidase alfa)後,賽諾菲(Sanofi)再一項該病治療藥物獲批准。Nexviazyme 的療效是基於COMET臨床試驗,結果顯示與 Myozyme 相比,以 Nexviazyme 治療的病人在第49週後,用力呼氣肺活量(FVC)達到與 alglucosidase alfa 非劣性的結果。此外,與基準線相比,接受 Nexviazyme 治療的患者多走 32.2 公尺,在同一時間點比接受 Myozyme 治療的患者多走 30 公尺。
5. 首支侏儒症藥物 Voxzogo 核准上市
軟骨發育不全症是一種沒有治療藥物的罕見疾病,會導致常見的侏儒症,美國大約有 10,000 多名兒童罹患此病。FDA今年核准了此病第一種治療藥物 Voxzogo(vosoritide)注射液,適用5歲以上患有軟骨發育不全且仍有開放生長板,仍有生長潛力的兒童。臨床研究結果顯示,與使用安慰劑的兒童相比,vosoritide 組別的兒童身高年平均多了 1.57 公分。仍有其他製藥公司投入研發此領域治療方案,包括 Ascendis Pharma、Pfizer 以及 Tyra Biosciences。
詳細報導請點擊6. 偏頭痛預防性藥物 Qulipta 投入競爭市場
雖然市場上已有偏頭痛預防發作的藥物,不過 Qulipta(atogepant)仍為首支也是唯一一款專為預防性治療偏頭痛而開發的口服 CGRP(calcitonin gene-related peptide)受體拮抗劑。臨床試驗研究結果顯示,與安慰劑相比,使用Qulipta 的組別患者在 12 週內的每月偏頭痛天數減少了 50-100%。偏頭痛問題非常普遍,約影響全球 10 億人,是 50歲以下人口失能的主因。偏頭痛預防藥物市場除了 AbbVie 之外,還有 Eli Lilly、Amgen 以及 Biohaven Pharmaceutical Holding Co Ltd。
7. T2D 慢性腎病首支非類固醇皮質激素受體拮抗劑 Kerendia
全球約有 7 億人口患有慢性腎臟病,高危險群包括糖尿病患者,而II型糖尿病(T2D)患者中有 40% 會罹患慢性腎臟病,首支非類固醇皮質激素受體拮抗劑 Kerendia(finerenone)可降低 eGFR 持續下降、腎功能衰竭、T2D 相關慢性腎病成人患者其心血管死亡、非致命性心肌梗塞和心衰竭住院治療的風險。此藥物是同類最優(first-in-class)的非類固醇鹽皮質激素受體拮抗劑(MRA),相關臨床試驗FIGARO-DKD研究結果顯示,可將首次發生心血管(CV)死亡或非致命性心血管事件(心肌梗塞、中風或心臟衰竭住院)的複合主要終點的風險顯著降低 13%。
詳細報導請點擊8. 首支針對 KRAS 突變肺癌標靶藥物 Lumakras
長期以來 KRAS 突變一直被認為對藥物治療具抗藥性,今年 5 月時 FDA 核准 KRAS G12C 特定基因突變非小細胞肺癌的標靶藥物 Lumakras(sotorasib),而 KRAS G12C 突變約占非小細胞肺癌突變的 13%。此藥除了比預期中提早 3 個月被核准之外,上市 4 個月以來,累計銷售額達 4500 萬美元。
詳細報導請點擊9. 首支子宮內膜癌抗 PD-1 療法 Jemperli
晚期和復發性子宮內膜癌女性在接受含鉑化療方案的一線標準治療後,治療選擇有限,抗 PD-1 療法 Jemperli(dostarlimab)獲得 FDA 加速批准,用於治療接受鉑類化療期間或之後病情進展、錯配修復缺陷(dMMR)復發或晚期子宮內膜癌。而復發或晚期子宮內膜癌當中,25% 至 30% 患者有 dMMR 腫瘤。在相關臨床試驗 GARNET 研究中,接受 Jemperli 治療的 71 例復發或晚期 dMMR 子宫内膜癌患者,42.3% 的病人完全緩解或部分緩解,93% 患者病情緩解的持續時間大於 6 個月。
詳細報導請點擊10. 復發或難治性晚期腎細胞癌 TKI 藥物 Fotivda
復發或難治性晚期腎細胞癌是一種難治疾病,患者的治療結果可能會受到限制,而 FDA 核准口服標靶藥物 Fotivda(tivozanib)用於曾經接受過2次或多次全身治療的成人患者,帶來一線曙光。相關臨床試驗 TIVO-3 研究顯示,與sorafenib 組相比,tivozanib 組的 PFS 延長 44%(5.6 個月 VS. 3.9 個月),具有統計學意義的顯著差異,疾病進展或死亡風險也降低了。
詳細報導請點擊11. FDA 緊急授權核准首款新冠口服藥
輝瑞(Pfizer)的新冠口服藥物 Paxlovid 於 12 月獲 FDA 緊急使用授權許可,為 FDA 核准的首款抗新冠病毒口服藥。 Paxlovid 結合兩種抗病毒藥物:nirmatrelvir 及 ritonavir,用於治療 12 歲以上輕度至中度新冠患者。接受 Paxlovid 治療後,3 天內住院風險下降 89%,5 天內死亡風險下降 88%,且對 Omicron 變種有效性維持不變。Paxlovid 的優勢是患者可在家自行服用,不需在醫院即可接受治療。
詳細報導請點擊接下來,基因線上也將精選年度 IPO、M&A、值得期待的生物技術等主題,與讀者回顧國際生醫精彩進展,請持續鎖定關注!
延伸閱讀:基因線上 2021 年精彩重現!年度精選 10 大國際生醫新聞參考資料:
- https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2021
- https://www.beckershospitalreview.com/pharmacy/16-cancer-drugs-approved-in-2021.html
- https://www.fda.gov/news-events/press-announcements/fda-grants-accelerated-approval-alzheimers-drug
- https://pubmed.ncbi.nlm.nih.gov/34338436/
- https://www.ema.europa.eu/en/medicines/human/summaries-opinion/aduhelm
- https://investors.biogen.com/news-releases/news-release-details/biogen-announces-reduced-price-aduhelmr-improve-access-patients
- https://www.merck.com/news/merck-announces-u-s-fda-approval-of-verquvo-vericiguat/
- https://www.businesswire.com/news/home/20210120005289/en/Merck-Announces-U.S.-FDA-Approval-of-VERQUVO%C2%AE-vericiguat
- https://www.fda.gov/news-events/press-announcements/fda-approves-first-extended-release-injectable-drug-regimen-adults-living-hiv
- https://www.businesswire.com/news/home/20210717005014/en/ViiV-Healthcare-study-shows-new-long-acting-HIV-regimen-Cabenuva-cabotegravirrilpivirine-can-be-successfully-implemented-in-broad-range-of-US-healthcare-practices-even-during-COVID-19
- https://www.fda.gov/news-events/press-announcements/fda-approves-new-treatment-pompe-diseas
- https://www.fda.gov/news-events/press-announcements/fda-approves-first-drug-improve-growth-children-most-common-form-dwarfism
- https://news.abbvie.com/news/press-releases/fda-approves-qulipta-atogepant-first-and-only-oral-cgrp-receptor-antagonist-specifically-developed-for-preventive-treatment-migraine.htm
- https://www.nasdaq.com/articles/u.s.-fda-approves-abbvies-migraine-prevention-drug-2021-09-28-0
- https://www.businesswire.com/news/home/20210828005016/en/Bayer-Announces-KERENDIA%C2%AE-finerenone-Reduces-the-Risk-of-Cardiovascular-Outcomes-in-New-Phase-III-FIGARO-DKD-Study-in-Adults-With-Chronic-Kidney-Disease-Stages-1-4-Associated-With-Type-2-Diabetes
- https://www.nejm.org/doi/full/10.1056/NEJMoa211095
- https://www.fda.gov/news-events/press-announcements/fda-approves-first-targeted-therapy-lung-cancer-mutation-previously-considered-resistant-drug
- https://www.fda.gov/news-events/press-announcements/fda-approves-immunotherapy-endometrial-cancer-specific-biomarker
- https://www.gsk.com/en-gb/media/press-releases/gsk-receives-fda-accelerated-approval-for-jemperli-dostarlimab-gxly-for-adult-patients-with-mismatch-repair-deficient-dmmr-recurrent-or-advanced-solid-tumours/
- https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-tivozanib-relapsed-or-refractory-advanced-renal-cell-carcinoma
- https://www.pfizer.com/news/press-release/press-release-detail/pfizer-receives-us-fda-emergency-use-authorization-novel
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com