2016 年,時任美國哈佛大學的謝曉亮(X.Sunney Xie)教授和億康基因(Yikon Genomics)的陸思嘉(Sijia Lu)博士研究團隊在《美國國家科學院院刊》(Proceedings of the National Academy of Sciences of the United States of America, PNAS USA)發表了一篇研究論文,透過一種自主開發名為 MALBAC(Multiple Annealing and Looping-based Amplification Cycles)的專利技術方法(WO2012166425A2 WIPO PCT,2012 年同步發表於 Science 雜誌,序列擴增覆蓋效率高達 93%)進行全基因染色體擴增(Whole Genome Amplification)。
擴增技術優化!僅透過細胞培養液也能取得足量 cfDNA 進行胚胎染色體分析
該技術成功從胚胎細胞培養液中純化擴增出懸浮的細胞游離 DNA(cfDNA),經過次世代基因定序分析(Next Generation Sequencing, NGS),對試管嬰兒療程的受精胚胎進行全染色體序列篩檢,透過非侵入性的採樣方式(亦不需在胚胎上打洞讓囊胚腔液流出與細胞培養液混合),同樣達成胚胎著床前染色體基因篩檢(PGS/PGT-A)的目的。
研究數據顯示,透過胚胎細胞培養液得到的基因定序結果與直接採取整顆胚胎細胞進行基因定序的黃金標準結果相比較,敏感度(Sensitivity)為 88.2%,特異性(Specificity)為 84.0%,陽性預測率(PPV)為 78.9%,陰性預測率為 91.3%,二者之間的吻合度達 85.7%,參與試驗的 42 顆胚胎也都未有檢測失敗的情況,具有相當高的臨床參考意義,開始受到全球生殖醫學領域專家的高度關注。
細胞培養液混合囊胚腔液,試圖取得較多的游離 DNA(cfDNA) : mi-PGS/mi-PGT-A
2017 至 2018 年間也有中國的研究團隊嘗試採用胚胎囊胚液(Blastocoel Fluid)與細胞培養液混合 embryo culture medium/blastocoel fluid(ECB)的取樣方式,以獲取較多游離 DNA,經過擴增與基因定序分析,與細胞採樣的 PGT-A 和經過細胞採樣的剩餘胚胎的分析分別來做對照比較,並將這樣的方法稱為微侵入性胚胎著床前染色體基因篩檢(mi-PGS/mi-PGT-A)。結果顯示,若將剩餘的整顆胚胎當作黃金標準對照組:
細胞採樣 PGT-A 組
- 敏感度(Sensitivity)為 89.47%
- 特異性(Specificity)為 73.63%
- PGT-A 組和整顆胚胎組的結果一致性為 72.5%(27.5% 不同)
ECB 組
- 敏感度(Sensitivity)為 89.47%
- 特異性(Specificity)僅有 68.42%
- ECB 組和整顆胚胎組的結果一致性為 50%
最後,PGT-A 和 ECB 組的結果一致性則僅有 45%。
2018 年加拿大多倫多大學的研究團隊也發表了相同方法學的研究論文,用胚胎囊胚液(Blastocoel Fluid)與細胞培養液混合 embryo culture medium/blastocoel fluid 發現:
- NI-PGT-A 與整顆剩餘胚胎的一致性為 96.4%
- TE 細胞 PGT-A 和整顆剩餘胚胎的一致性為 91.7%
最後,NI-PGT-A 與 TE 細胞 PGT-A 的一致性是 87.5%。
2019 年以陸思嘉(Sijia Lu)博士為首的研究團隊則搜集了 41 顆胚胎來自 22 對親代具有染色體轉位的夫妻,以胚胎囊胚液(Blastocoel Fluid)與細胞培養液混合的方式並且將實驗流程條件做了一些優化(BCM 組),與 TE 細胞採樣組和剩餘的整顆胚胎(BE 組)來做比較,不僅分析染色體倍數異常的結果(PGT-A),更進一步去分析這些胚胎發生染色體轉位的情況(PGT-SR)。
PGT-A 的分析結果:
- BCM 組與 BE 組的一致性為 76.19%
- TE 組與 BE 組的結果一致性也為 76.19%
但令人意外的是,PGT-SR 的分析結果,BCM 組與 BE 組的一致性為 90.24%,TE 組與 BE 組的結果一致性則是 100%。
非侵入性的 NI-PGS/ni-PGT-A 結果,比傳統胚胎切片的 PGS/PGT-A 更具代表性
2019 年美國哈佛大學的謝曉亮(X.Sunney Xie)教授團隊和哈佛大學醫學院旗下布萊根婦女醫院(Brigham and Women’s Hospital)的權威胚胎學家 Catherine Racowsky 教授團隊合作,再度在《美國國家科學院院刊》發表了關鍵性的研究成果:透過高效率的 MALBAC(Multiple Annealing and Looping-based Amplification Cycles)擴增技術不僅能直接採取胚胎細胞培養液中的 cfDNA 進行染色體分析,檢測結果竟比傳統採取外胚層細胞(Trophectoderm cell)的 PGS/PGT-A 更吻合整顆胚胎的真實染色體分佈情況。
他們對於同一批胚胎分別採取胚胎細胞培養液、滋養外胚層細胞(Trophectoderm cell)和整顆胚胎(內胚層+滋養外胚層)三種檢體樣本進行擴增與基因定序分析,將整顆胚胎(內胚層+滋養外胚層)的結果當作黃金標準,分別用胚胎細胞培養液和滋養外胚層細胞(Trophectoderm cell)這兩組的結果分別與整顆胚胎(黃金標準)做比較。
同時,他們發現將判定標準(Threshold)設定在 60% 細胞鑲嵌(60% Mosaicism)訊號時,能夠最精準區別的染色體整倍體(Euploidy)與染色體非整倍體(Aneuploidy)的胚胎結果判定。
在這樣的判定標準制定下,二組的敏感度(Sensitivity)與陰性預測率(Negative Predictive Value, NPV)皆達到 100%,偽陽性率(FNR)則為 0%,幾乎達到相同水平。更值得一提的是,NI-PGT-A 的組別在特異性(Specificity)80% 和陽性預測率(PPV) 91.7% 的表現都明顯比傳統 PGT-A 的 50% 和 78% 來得優異,偽陽性率(FPR)的表現 NI-PGT-A( 20.0%)也顯著優於 PGT-A(50%),大幅改善過往 PGT-A 被反對者質疑的偽陽性率高所造成的道德倫理議題。
進一步深入分析二組分別在染色體非整倍體(Aneuploidy)和染色體片段缺失/重複(Deletion/Duplication/CNV)的表現,NI-PGTA 在非整倍體的結果的一致性(Concordance)達 93.8%,傳統 PGT-A 的吻合度則為 82.0%,差異為 11.8%。而在染色體片段缺失/重複(Deletion/Duplication/CNV)的吻合度,NI-PGT-A 為 83.3%,傳統 PGT-A 則為 62.0%,二組之間差異高達 21.3% 更為顯著。
上述研究數據揭示著,NI-PGT-A 可能比傳統 PGT-A 更能忠實呈現胚胎整體的染色體狀況,尤其是在以往偵測較困難的染色體片段缺失/重複(Deletion/Duplication/CNV)項目,NI-PGA 的表現似乎更勝於傳統 PGT-A,能提供更可靠的臨床參考意義。
2020 年西班牙 Carlos Simons 研究團隊也在《美國婦產科雜誌》American Journal of Obstetrics and Gynecology 發表了他們在歐洲的研究,比較採取胚胎細胞培養液 cfDNA 和採取 TE 細胞進行胚胎染色體基因篩檢的。研究數據顯示 NI-PGT-A 和 TE biopsy PGT-A 二種不同採檢方法的比較:
- NI-PGT-A 和 TE biopsy PGT-A(對照組)的一致性(Concordance)為 78.2%(全染色體結果接吻合 67.7% 部分吻合 10.5%)
- 敏感度(Sensitivity)為 81.7%
- 特異性(Specificity)為 77.4%
- 陽性預測率(PPV)為 75.0%
- 陰性預測率(Negative Predictive Value, NPV)為 83.6%
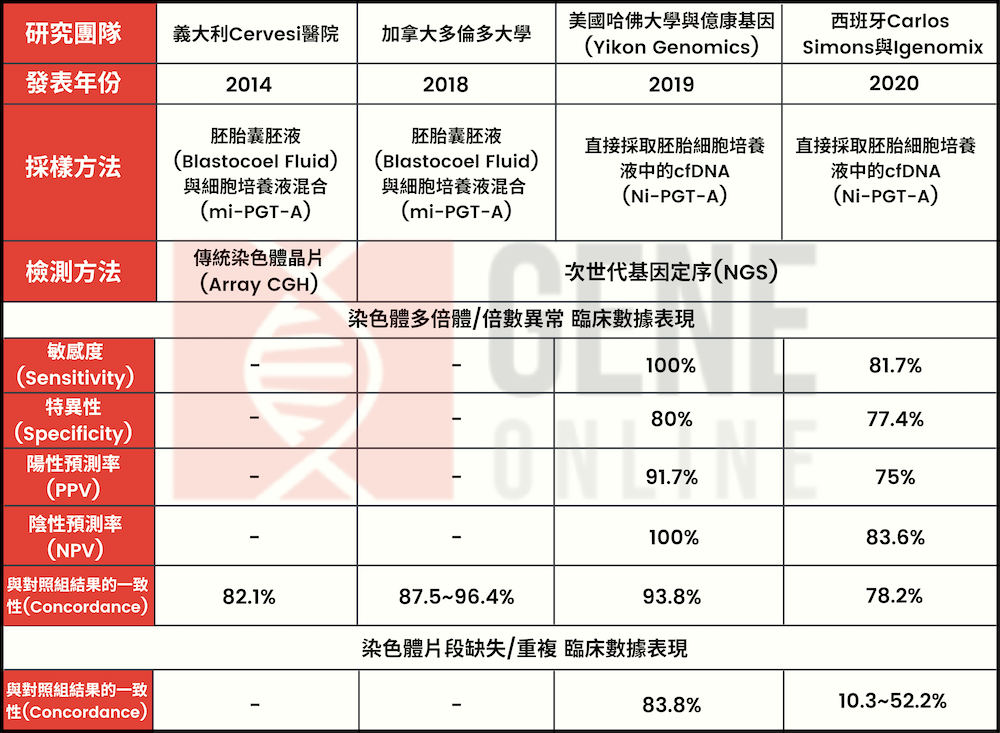
除了染色體倍數異常以外,NI-PGT-A 在研究當中也被用來檢測染色體片段缺失/重複與 PGT-A 的吻合度,其研究結果顯示,在染色體缺失的吻合度約為 52.2%,而在染色體重複的吻合度則僅有 10.3%,都明顯低於染色體倍數異常的水準(P<0.0001)。
另一方面,此篇研究收案的檢體當中,有 5.4% 的 NI-PGT-A 檢體在 DNA 擴增與基因定序的過程中無法出具分析結果,相較於 PGT-A 的檢測失敗率 2.0%,檢測失敗的比例高出 2.7 倍,這樣的結果更突顯出穩定而高效能的 DNA 擴增技術在 NI-PGT-A 檢測當中扮演至關成敗的關鍵性角色。
由於細胞培養液中的 DNA 含量非常稀少,精良的全染色體擴增(WGA)技術和胚胎培養與檢體的採集方法就變得至關重要,從後續的研究當中也陸續發現證實,影響 NI-PGS/NI-PGT-A 分析結果的二大關鍵因素:
過低的 cfDNA 濃度/含量或擴增效率與品質不夠好的全基因染色體擴增技術
NI-PGS/NI-PGT-A 的技術原理和近年火紅的非侵入性胎兒染色體基因檢測(NIFTY/NIPT)有著異曲同工之妙,都是從液態生物檢體(Liquid Biopsy)中萃取純化出游離的 DNA 片段後續進行全基因染色體擴增和 DNA 基因定序分析。然而,2018 年美國婦產科醫學權威 Diana Bianchi 教授發表在新英格蘭雜誌的 review 文章提到,已有研究文獻證實過低的胎兒 cfDNA 濃度會影響是導致 NIPT 分析結果偽陰性最主要的原因之一。
因此,在部分 NI-PGS/NI-PGT-A 的研究論文當中也有提到,如何取得足量的 cfDNA 和擴增效率與品質優良的全基因染色體擴增(WGA)流程,是影響 NI-PGS/NI-PGT-A 分析結果的最關鍵性因素。
胚胎上來自母方/父方來源的生物性因素
胚胎受精早期卵子上殘留來自母體 DNA 或是來自黏著在卵子表面的殘留精蟲 DNA,都可能會在分析過程中造成極大的干擾因素,因此在檢體採集的流程中都會要求在胚胎受精後的第 3 或 4 天進行更換胚胎培養液甚至潤洗的步驟,避免這些干擾因素殘留在胚胎細胞培養液中影響後續 NI-PGS/NI-PGT-A 分析結果。
攸關 NI-PGS 檢測品質與成效的決定性因素
同理可證,來自胎兒和胚胎的 DNA 樣本都極其微量,對於檢測技術、實驗流程與環境控管都具有極高的挑戰性。cfDNA 是游離在細胞培養液當中的破碎 DNA 片段,非常容易受到外在環境條件的影響而被降解而破壞殆盡,相較 PGT-A 是直接取得 3-5 顆 TE 細胞進行 DNA 萃取與擴增,ni-PGT-A 需要更高的技術水平和更嚴格的條件控管,以下可能是攸關檢測結果品質的三大關鍵因素:
高效且均勻的 DNA 擴增技術
來自胚胎細胞 cfDNA 非常微量,必須經過全基因染色體擴增(Whole Genome Amplification)的關鍵步驟來等量放大所有的cfDNA片段,才能夠忠實地反映出從胚胎染色體 DNA 拷貝數變異(Copy Number Variation, CNV)的情況。因此,必須採取高效且均勻的DNA擴增技術,例如: MALBAC(Multiple Annealing and Looping-based Amplification Cycles),來解決檢測失敗率偏高和因為擴增不均勻而造成基因定序分析的二大關鍵性問題。
無塵室規格的全正負壓實驗室操作環境
NI-PGS/NI-PGT-A 檢測所採取的胚胎 cfDNA,由於是極短片段(100bp左右)的微量DNA,非常容易受到外在因素而降解殆盡,直接導致檢測失敗。操作環境中只要有任何一點不明物質存在,都可能造成 DNA 樣本受到污染,會直接影響 NI-PGS/NI-PGT-A 的基因定序分析精準度。
因此,全程必須要在具備無塵室等級的全正負壓實驗室進行操作,才能確保檢測品質。若僅在一般的分子生物實驗室或沒有全正負壓的無塵實驗室環境操作,雖然成本相對低廉,但可能必須承擔更多的檢測失敗和品質風險。
是否具有公開臨床數據驗證的技術來源
NI-PGS/NI-PGT-A 是一項嶄新的新技術,目前已經知道有包括: 義大利 Cervesi 醫院、加拿大多倫多大學、西班牙團隊和美國哈佛大學謝曉亮教授技術授權的億康基因(Yikon Genomics)等研究團隊都有將他們的技術與研究數據公開發表,不同研究團隊得到的臨床數據和效度也因為檢測技術、演算方法、樣本人種等因素而有所不同。
現在也有一些檢測服務供應商,陸續開始在歐、美、亞洲等地提供相關的檢測服務。然而,在進行臨床檢測服務之前,必須先釐清其技術來源,是否已具有臨床數據公開發表可供驗證,甚至考量是否有足夠在地亞洲人種樣本做為數據比對分析基礎,以確保 NI-PGS/NI-PGT-A 檢測分析的可信賴度。
此外,更應該避免依樣畫葫蘆仿傚模式,在未經公開驗證與臨床檢測效度不明的情況下貿然提供相關檢測的臨床服務,避免衍生無法掌控的風險和爭議。
非侵入性胚胎著床前染色體篩檢(NI-PGS/PGS)臨床應用的挑戰與展望
NI-PGS/NI-PGT-A 的原理是蒐集胚胎釋放到細胞培養液中的 cfDNA,然而在胚胎受精後一般常見的群體培養(Group Culture)是將一批數顆胚胎同時培養在同一個培養液滴或槽內,因為共用培養液而無法確保 DNA 的來源性,造成分析上的困難。
這個情況與非侵入性胎兒染色體基因檢測(NIFTY/NIPT)在多胞胎妊娠案例上所遇到的困境限制非常類似。因此接受檢測的胚胎必須採取單獨培養(Single Culture),讓每一個胚胎在個別獨立的培養槽或培養液滴當中培養生長,才能蒐集到單一來源性的 DNA。
另一方面,近年來蔚為風尚的 3.5 代試管嬰兒,是在 IVF 療程搭配 PGS/PGT-A 再加上縮時攝影胚胎培養(Time Lapse Embryo Culture System)的即時記錄監測,甚至運用影像分析軟體的演算法來輔助判斷胚胎的優劣等級(但從外觀仍無法精準分辨胚胎是否有染色體異常,仍須透過基因檢測分析來找出染色體異常的胚胎),是目前臨床上相當受到歡迎的試管嬰兒療程配套方案。
但是由於大多的縮時攝影胚胎培養(Time Lapse Embryo Culture System)的設計是在數個胚胎孔槽之間相通共用細胞培養液,無法滿足胚胎需要在單獨培養液環境中的條件,成為目前 NI-PGS/NI-PGT-A 尚無法大量應用的技術障礙之一。
不過,正因為 NI-PGS/NI-PGT-A 強烈的市場需求潛力,已有部份的縮時攝影胚胎培養(Time Lapse Embryo Culture System)設備業者開始投入設計可符合獨立培養條件的胚胎培養盤,相信在之後這樣的技術問題將可能迎刃而解。可以預期不久的未來,這個嶄新的技術將會在生殖醫學領域有非常廣泛且重要的應用。
作者:John Hung
生殖醫學嶄新亮點(上)- 非侵入性胚胎著床前染色體基因篩檢(Ni-PGT-A)參考資料:
- Genomic DNA in human blastocoele fluid. Reprod Biomed Online. 2013 Jun;26(6):603-10.
- Blastocentesis: a source of DNA for preimplantation genetic testing. Results from a pilot study. Fertil Steril. 2014 Dec;102(6):1692-9.e6.
- Noninvasive chromosome screening of human embryos by genome sequencing of embryo culture medium for in vitro fertilization. Proc Natl Acad Sci 2016; 113:11907–11912.
- Non-invasive preimplantation aneuploidy screening and diagnosis of beta thalassemia IVSII654 mutation using spent embryo culture medium. Ann Med 2017; 49:319–328.
- Preimplantation genetic screening with spent culture medium/blastocoel fluid for in vitro fertilization. Sci Rep 2018;8: 9265.
- Minimally invasive preimplantation genetic testing using blastocyst culture medium. Hum Reprod 2019; 34:1369–1379.
- Chromosome screening using culture medium of embryos fertilised in vitro: A pilot clinical study. J Transl Med 2019; 17:1–8.
- Noninvasive preimplantation genetic testing for aneuploidy in spent medium may be more reliable than trophectoderm biopsy. Proc Natl Acad Sci 2019; 116:201907472.
- Multicenter prospective study of concordance between embryonic cell-free DNA and trophectoderm biopsies from 1301 human blastocysts. J Obstet Gynecol. 2020 Nov;223(5):751.e1-751.e13.
- Evaluation of a novel non-invasive preimplantation genetic screening approach. PLoS One. 2018; 13(5): e0197262.
- Sequencing of Circulating Cell-free DNA during Pregnancy. N Engl J Med. 2018 Aug 2;379(5):464-473.
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com