羅氏(Roche)於11月7日(美國時間)宣布,美國食品藥物管理局(US Food and Drug Administration,簡稱 FDA) 核准 VENTANA ALK(D5F3) 伴隨式診斷試劑,用於判斷間變性淋巴瘤激酶(Anaplastic lymphoma kinase,簡稱 ALK)陽性(positive)非小細胞肺癌(non-small cell lung cancer,NSCLC)患者是否適用於使用他們公司藥物 alectinib(艾樂替尼,Alecensa)的治療。
然而,FDA 分別於 2015 年 6 月和 2017 年 6 月,核准該伴隨式診斷試劑,用於判斷ALK陽性非小細胞肺癌患者是否適用於使用輝瑞藥廠(Pfizer) 上市的藥物 crizotinib(截剋瘤,Xalkori)使用諾華藥廠(Novartis)上市的藥物ceritinib(色瑞替尼,ZYKADIA)。
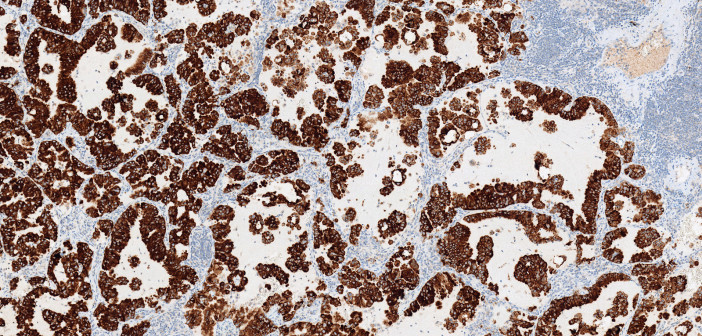
羅氏組織診斷部門(Roche Tissue Diagnostics)的負責人 Ann Costello 博士指出,這項免疫組織化學染色法(immunohistochemistry,簡稱 IHC)提供非小細胞肺癌患者重要資訊,來幫助他們選擇適當的治療藥物。使用簡單的 IHC 測試,就能快速鑑定出患者是否為 ALK 陽性,這使得更多患者從標靶治療獲得更多益處。羅氏更指出,在非小細胞肺癌中,偵測和抑制 ALK 生物標記,能使 ALK 陽性患者的腫瘤縮小。
福馬林固定石蠟包埋(in formalin-fixed, paraffin-embedded,FFPE)的非小細胞肺癌組織中的 ALK 蛋白,經羅氏 Roche BenchMark XT 或 BenchMark Ultra全自動免疫組織化學染色暨原位雜交染色儀(IHC/ISH)染色之後,再由 VENTANA ALK(D5F3)CDx 進行定性檢測。
延伸閱讀:首例 ! 次世代定序的伴隨式診斷試劑 CDxBRCA 獲 FDA 批准與其在實驗室想破頭,不如…….參與面對面的研究討論,2017 NGSC 帶你突破瓶頸。
首圖來源:
http://www.ventana.com/roche-receives-FDA-approval-for-VENTANA-ALK-D5F3-CDx-Assay-to-identify-lung-cancer-patients-eligible-for-treatment-with-Roches-ALECENSA-alectinib
參考資料:
https://www.genomeweb.com/regulatory-news/roche-alk-test-gains-fda-approval-cdx-alecensa
https://usinfo.roche.com/alk
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com