精準醫療(Precision Medicine)是目前全球醫療趨勢,次世代定序技術的進步與大數據的竄起,使得各國紛紛將資源投入精準醫療的發展,台灣亦不落人後加入行列積極研發。
楊志新醫師,目前為國立臺灣大學醫學院附設醫院癌醫中心分院院長也是中華民國癌症醫學會理事長,是確立標靶治療為 EGFR 突變肺癌標靶一線療法的頂尖學者,他執行及主導的一序列臨床試驗大幅延長晚期肺癌病人的存活期。因為此重大貢獻,國際肺癌研究學會於今年 8 月 6日頒發「特殊科學貢獻獎」予楊志新,是首位獲獎的台灣人。
此次基因線上有幸邀請到國立臺灣大學醫學院附設醫院癌醫中心分院楊志新院長,針對台灣精準醫療現況以及未來的展望進行分享。
2022 MGTO 研討會精彩回顧,MTB 樹立癌症精準醫療新里程碑!基因檢測使精準醫療更加「精準」
「精準醫療不是現在大家所想像的基因檢測這樣狹義的定義而已,不應該只看基因、蛋白質、RNA,而是應該以如何提供病人最準確、最精準的治療方針才是所謂精準醫療的定義。」楊志新院長解釋。
對於精準醫療的現況,楊院長侃侃而談,從有醫學開始,醫師們即開始走向精準的路線。從癌症病理組織的辨識到來源器官的確認,癌症的分類及治療日趨複雜。
癌症治療皆採取「標準療程」,但是以往治療主流如化學治療和癌症的種類較相關,治療效果也難預測。然而,近年來標靶治療逐漸成功的使用在各種癌症,使科學家瞭解到具不同基因突變的癌細胞,需要不同種類的標靶治療。因此,如果透過檢測癌症基因或蛋白質表現高低,找出病人的腫瘤帶有哪些癌症基因突變或蛋白質表現的變異,使醫師能針對帶有特定基因突變或蛋白質表現的變異的病人擬定適合的治療策略,以達到更佳的治療效果。而依據每位病患癌組織的基因或蛋白表現的特性,精準選擇用藥的治療新趨勢就叫做「精準醫療」。舉例來說,光是 EGFR 突變中就有許多變異,而這些變異又有相對應的治療,這對剛入行的腫瘤科醫師而言,無疑是項挑戰。
「基因檢測的確在醫療上是跨出一大步的里程碑。基因檢測在過去 10-20 年間進步許多,同樣的病理組織檢測型態若基因表現不同,則病人對標靶或免疫治療反應會完全不同。」
另一方面,不同的癌症有時會有相同的突變,但並無法確定是否給予相同的藥物會得出相同的療效。一旦將疾病漸漸區分,過往的一些試驗將無法滿足隨著基因檢測發達而出現的治療方向,造成極大的治療鴻溝。以往的基因檢測已由傳統的 Sanger sequencing 這種基因定序方式,發展出個別基因的 CDx 伴隨式診斷,或者是用基因的表現來預測基因突變的檢測方式;而 NGS 次世代定序可以廣泛地檢測出多個不同基因變異,可使基因檢測更有效率,有望使治療更加的「精準」。
次世代定序 NGS 之臨床應用
NGS 是用於評估基因中 DNA 序列的技術。NGS 可以將數百個甚至數千個基因同時以相對較低的成本快速定序。在臨床精準醫學的應用上,扮演不可或缺的角色。楊院長提到驅動基因 (driver gene) 的概念, 亦即一個癌症病人所有細胞都由單一基因變異驅動生長。有些特定癌症存在單一驅動基因,給予標靶藥物時,大多數有特定相對驅動基因突變的病人腫瘤會縮小,而當給予藥物若僅有小部分病人有反應即可懷疑仍有其他變異基因在干擾,或是這病人癌細胞只有小部分有此基因突變。在次世代基因檢測,同一基因片段必須深入且多次檢測,同時分析其出現的頻率,如果頻率很高,代表大部分的細胞都有此突變,如果頻率太低即代表並非所有癌細胞都有。一開始病理組織也需要由病理科醫師檢查癌細胞和正常細胞的比例。若比例過低,檢驗常出現偽陰性。
院長同時建議,為了促進精準醫學在臨床癌症上的良好運作,應盡速將 NGS 應用於某些特定癌症臨床診療常規,藉由統整基因數據的報告和解讀以確保提供更精準的治療決策。目前 ESMO Scale of Clinical Actionability for molecular Targets,以下簡稱 ESCAT (中文名「腫瘤分子標靶臨床用藥可行性量表」)根據現有證據,於特定基因變異使用對應用藥之臨床治療價值提出實作建議,以識別哪些基因變異應納入常規臨床檢驗以及臨床治療方針。在訪談中,楊院長特別解釋各項分級且強調這些分級應用於精準醫療臨床上之重要性。以下以層級一到三 (Tier I – III) 為例,層級 I (Tier I – Ready for routine use):基因變異與其對應用藥在臨床試驗中已證實能增進治療成效,應列為常規檢測和治療。依據臨床試驗的證據強度,又可區分為層級 I-A、I-B、I-C 等三個次等級;層級 II (Tier II – Investigational):這類基因變異與其對應用藥仍在研究階段。雖然已有臨床研究證實具抗腫瘤效果,但仍有待確認其療效強度。亦即,該病人很可能適用此藥物,但仍需更多的證據佐證,因此也建議治療時應同時收集臨床資料以累積實證;層級 III (Tier III – Hypothetical target):在其他腫瘤上,已證實該基因變異與對應用藥具臨床成效,應用在不是罹患該類型腫瘤的病人身上可能有所助益,此類治療尚處於假設理論階段,建議應與病人討論參與相關的臨床試驗。層級 III 依據臨床試驗治療成效上的證據強度,亦可區分為層級 III-A 與層級 III-B 兩個次等級。
為了更加清楚 ESCAT 分級,本文特別將 ESCAT 相關分級整理如下圖:
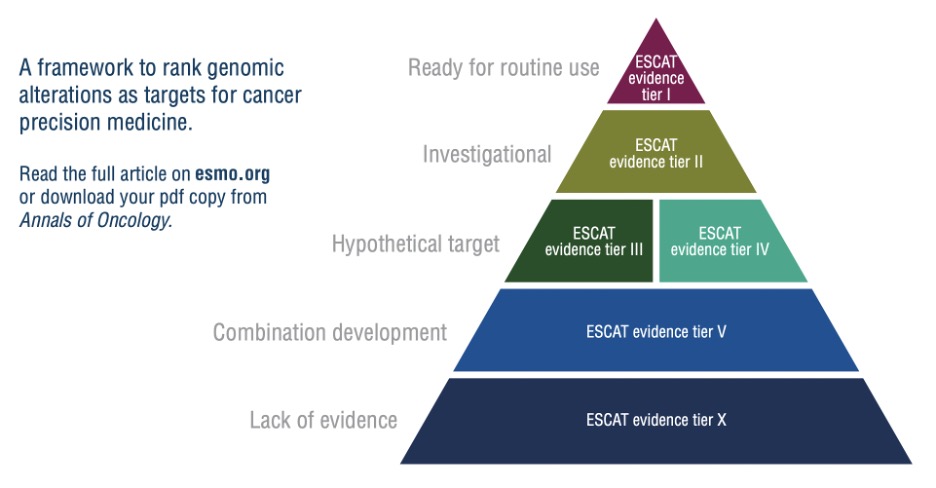
建立基因資料庫將有助降低篩檢成本
在提到基因資料庫時,楊院長提醒:「一般正常人基因資料庫與癌症基因完全是兩回事。一般正常人基因資料庫是檢測正常人基因且藉由基因譜大數據及長期追蹤參與者日後罹病的狀況,用不同個體基因變異(polymorphism)來預測日後致癌或其他疾病的風險,進而提供未來治療或預防的方向。但癌症病人基因檢測,則是針對癌症病人基因已突變 (mutation) 的癌組織檢驗來擬定治療。」
楊院長認為,群體基因資料庫蒐集及研究對於台灣來說有很大的優勢。台灣有健保資料加上大醫院幫忙收集資料建立百萬人的基因資料庫。基因資料庫收集的是正常的基因,可以用基因資料來研究及預測將來有哪些人可能會得癌症或其他疾病,即可提早預防及介入。舉例而言,APC 基因突變與家族性腺瘤性息肉症 (Familial adenomatous polyposis; 簡稱 FAP) 相關、CDH1 基因突變就與胃癌相關、 p53 基因突變會導致遺傳性癌症等。希望能就基因資料庫的建立而找到家族癌症的案例,尋找未知的致癌基因,因為家族性癌症的發生通常與基因突變遺傳相關,而了解家族有哪些基因變異或許能預防癌症的發生。
家族遺傳性癌症篩檢的執行有很多爭論,例如人體細胞帶有 BRCA1 或 BRCA2 突變,病人一輩子有40∼70% 的機會得乳癌,而這一輩子除了乳癌之外得到卵巢癌的機會也會提高。歐美人士帶有此可遺傳基因的突變比例較高,因此常有病人家屬希望做此基因檢測。若檢測陽性,可以考慮預防性切除乳房及卵巢。
其實有許多的癌症篩檢看起來都很需要,但國家的經費有限,如果全部納入將會增加許多預算而造成國家無法負擔。舉例而言, B 型肝炎帶原者罹患肝癌的風險是沒有帶原者的百倍,台灣B型肝炎帶原率約為 15% ,亦即,約有 300 萬人有 B 型肝炎帶原且部分人群終其一生都不知道自己是 B 型肝炎帶原者,這些帶原者應終身作肝癌篩檢。但很多其他癌症的風險因子不是很高,只有個位數,例如常見的大腸癌、乳癌、不抽菸的肺癌等。因此,如果未來基因資料庫建立起來,應以基因組合先找出高危險群,針對這些人進行檢測,即可降低篩檢成本。

MTB 能減少治療的盲點
提到以真實世界實證(real-world evidence, RWE)作為評估的依據時,楊院長認為所謂的 RWE就是一個模擬科學性的探索過程,這與臨床試驗純科學不同,試驗計畫中會制定特定的病人群、搜尋特定的基因變異、針對特定的疾病給予特定的藥品,而且按照計畫書去嚴格執行,搜尋資料、分析個案、在規定時間內完成,是經由嚴格管控出來的結果與所謂的 RWE 相差甚遠。須了解在真實世界中的病人可能無法完全符合試驗的嚴格條件,但又需要用藥,嚴謹的臨床試驗無法完全回答真實世界的情況,因此這時醫師的經驗傳承極為重要,以確保病人及時治療。
以往每個醫師只能自己藉由自身過往的經驗,給予病人相對應的治療。但是 MTB(Molecular Tumor Board),集結各專家的經驗傳承,針對病人的病況,提供各自相關經驗,能更幫助醫師善用基因檢查的報告,以確保病人能得到最完善的治療。
「若可以透過 MTB 大家一起看病例,一起提供意見,不但可學習、幫助病人治療,還可以幫助大家多累積經驗。」楊院長強調
院長在採訪中也提到,癌細胞基因突變及生物標記變異及疾病治療效果的資料庫, 就是大家的理想,如果可以建立一個世界級的數據資料庫,畢竟許多基因的變異在醫師的職涯中並不會見到,藉由這些癌細胞基因變異及疾病治療資料庫,再結合 MTB 各專家的知識,不僅增加學習,亦使 MTB 的價值提升且將能造福更多的病人。
NGS 提供個人化醫療的更多資訊
分子病理可以告訴醫師許多資訊:例如基因變化、蛋白質變化、甚至免疫微環境的變化,都是日後分子檢測的重點,因此需要許多資源支持。以往此類基因檢測歸附在診斷,獲得健保的資源很少。相較於過往僅需一點檢體,看到癌細胞即可得出病理診斷結果。分子病理檢測在取樣與保留過程非常複雜及重要,以往的樣本量現在做分子病理檢測極可能不足。楊院長提出,如果要配合日後檢測發展,政府必須給予足夠的資源,如健保必須給付,分子檢測才能普遍的使用在病人身上。
推廣 NGS 的一項挑戰是時間。因為檢測結果需要兩、三個星期才會出來。例如在晚期肺癌的治療,一般單基因檢測如 EGFR 突變只需一星期內即有結果,若恰好是陽性即可開始治療。但肺腺癌要檢測的基因已達十種以上,若無法及時檢測出正確標靶基因突變,無法給予正確的標靶治療則必須給予化學治療。檢驗所需的時間是決定這類檢測能否落實以及推廣的重要因素。大多數病人無法等待太久,使 NGS 無法應用於所有病人;而價格亦是另一種挑戰,若要全面檢測需十多萬台幣,針對這項考量,楊院長樂觀表示,目前雖然昂貴,但隨著 NGS 越來越廣泛,價格也會逐漸降低。「前期診斷如果有更多資源,就可以有更準確的診斷,就比較容易針對疾病治療。」楊院長解釋。
院長亦提醒,在治療一段時間後,通常會有後續檢測追蹤新產生的突變,測得抗藥性相關的基因變異,往往可以嘗試使用雙標靶治療。對於本身資源足夠的病人,或許可以自費切片抽血密切追蹤,適時給予最精準的治療。但如果要推廣至全民眾,政府可能無法負擔。
台灣的現況與國外不盡相同,醫師大多會以已有健保給付的基因組合 (gene panel) 進行檢測。如上所述,目前健保給付的肺癌基因檢測如 EGFR、ROS1、ALK 是有相關核准藥物的,因此醫師在考慮病人治療時也會先以這些檢測結果為主。但肺癌的基因變異並非只有這三種,根據統計,目前已確定及研究中與標靶治療直接相關的基因變異將近五十種,若再加上基因印記 (genomic signature),則超過上百種,其他先進國家如日本、韓國已納入這些基因變異,乃至於更多更完整之全方位癌症基因檢測於健保給付行之有年,早已成為標準流程之一環,因此在跨國性臨床試驗不會額外提供這些基因檢測的情況下,台灣病人有可能喪失加入臨床試驗使用新藥的機會。同理,如果沒有爭取增加更多檢驗品項的給付,謹守著那三樣基因變異做研究,極可能永遠不知道其他基因變異的病人在哪,後果將嚴重影響後續台灣研究的競爭力及病人用藥的權利。
最後,院長建議,如果未來台灣想蓬勃發展生技業,就必須捨得在前期投資,因為這樣可獲得病人許多未知的臨床資訊,也有益於研發創新藥品及技術,亦會成為新知的創造者而非永遠處於追逐者的角色,替自己開創一片天地。
本文為羅氏大藥廠與基因線上合作專文 (M-TW-00003126)
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com






