生物會藉由細胞分裂持續替補和修復不堪用的身體部位,若運作得當理應能永續生存。但事實上生物都有其壽命限制,不得不屈服於老化。在 1961 年,美國生理學家 Leonard Hayflick 在培養人類胚胎細胞時即發現這些細胞沒辦法永無止盡的複製,大約分裂 40-60 次後就會進入休眠狀態。當多數細胞都進入休眠,身體就沒辦法自我修復,組織和器官就會累積各種殘缺,最後變得不堪使用 — 這就是老化過程。但是更了解老化機制後,有沒有可能打破天命的枷鎖?抗老化基因研究正在朝這個目標邁進。
端粒 — 決定人類老化的關鍵計時器?
「端粒」(Telomere)是位於細胞染色體末端的結構,是由許多重複核酸片段 (在人類為TTAGGG) 組成的 DNA 序列,可避免染色體末端的基因受到破壞或不小心接上其他染色體或基因序列。早在 1930 年代初期,美國遺傳學家 Hermann J. Muller 和 Barbara McClintock 就已發現端粒;而到了 1970 年代,美國遺傳學家 Elizabeth Blackburn 和 Jack Szostak 更深入闡明端粒的結構和功能,並發現端粒在細胞複製時都會少掉一部份的序列。當端粒短到某種程度後就無法繼續保護染色體,細胞也就會進入休眠狀態而不再複製。研究人員更發現氧化物質、心理壓力、和破壞核酸的外來因素 (如長期曝曬紫外線、抽菸、酗酒等) 也會造成端粒縮短,進而加速老化過程。
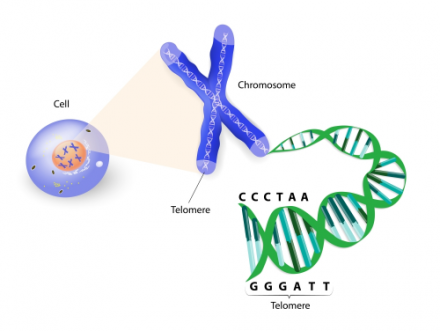
上圖:端粒 (Telomere) 是位於染色體末端雙鏈 DNA 的重複序列。每次細胞分裂,端粒變短,直至短到不再分裂。
自己的端粒自己加!
有趣的是,Szostak 教授後來發現酵母菌可在外來的 DNA 兩端加上端粒,而 Blackburn 教授的學生Carol W. Greider 更在 1984 年發現可延長端粒的酵素,稱之為「端粒酶」。Blackburn、Szostak、和 Greider 教授因其貢獻而共同獲頒 2009 年諾貝爾生理醫學獎。端粒也成為熱門的研究主題,每年會產出 1,000 篇以上相關的論文。目前有研究人員利用白血球端粒長度預測未來十年發生心血管疾病與癌症的機率,也有許多研究致力尋找可刺激端粒酶的藥物,讓端粒維持一定的長度停住老化的腳步。
天生我材必有用 — 為什麼生物體需要端粒?
既然端粒酶可以延長端粒長度,讓端粒酶持續工作是否就能實現長生不老的夢想?需要不斷複製的幹細胞、表皮細胞、或內皮細胞,其端粒酶皆相當活躍,端粒長度幾乎不變。不過還有另一類細胞也擁有異常勤奮的端粒酶,就是眾人聞之色變的癌細胞。它們毫不節制的生長,不受老化限制;而動物實驗也顯示在活體內大量表現端粒酶,將會大幅提高皮膚黑色素瘤、肺癌、以及膠質細胞瘤的發生風險。目前研究人員致力於找到長生和癌症之間的平衡,以避免顧此失彼、弄巧成拙。相信大家都希望得永生,但並不希望以長生不老的癌細胞形式存活在這個世界吧?!
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com
延伸閱讀:基因與老化系列專文(二) 延年益壽的靈丹?參考文獻:
1. 科技部高瞻自然科學教學資源平台中對於端粒的介紹
http://highscope.ch.ntu.edu.tw/wordpress/?p=12879
2. 諾貝爾獎得主Elizabeth Blackburn大師在2015年底於Science雜誌所發表關於端粒的最新見解
Blackburn EH et al. Human telomere biology: A contributory and interactive factor in aging, disease risks, and protection. Science 2015; 350:1193-8.