今年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)年会,最热门的议题当属:癌症免疫治疗 (Immuno-therapy) 或免疫肿瘤学 (Immuno-oncology),有相当多的临床试验数据和新药研究进展都在 ASCO 大会竞相发表,不仅是今年的当红炸子鸡,更是将来临床医疗的发展主流。
二十年磨一剑 癌症免疫治疗趋势崛起
论癌症免疫治疗的起源,可从 90 年代开始谈起,1992 年日本免疫学者 本庶佑 (Tasuku Honjo) 博士发现免疫细胞上的 PD-1 分子,其研究团队随后证明 PD-1 是 T 细胞上的抑制受体,在肿瘤逃避机制上扮演着关键角色。2001 年首度有研究指出,透过抑制剂阻断 PD-1 和 PD-L1 结合的分子机转,将能避免肿瘤细胞逃脱免疫T细胞的攻击,达到治疗癌症的效果。在 2008 年开始第一个临床试验后,直到 2014 年 PD-1 抑制剂 Opdivo(nivolumab)与 Keytruda(pembrolizumab)分别获得美国食品药物管理局 (FDA) 批准上市,全球开始掀起一股癌症免疫疗法的新浪潮。本庶佑 (Tasuku Honjo) 博士也在 2014 年获得唐奖的生物医药奖 (Tang Prize for Bio-pharmaceutucal Science) 的殊荣肯定。
近年来,免疫疗法的临床进展极为快速,截至目前就已经有 6 种免疫检查点抑制剂 (Immune Checkpoint Inhibitor) 药物,包括:PD-L1 抑制剂 (Atezolizumab、Avelumab、Durvalumab)、PD-1 抑制剂(Pembrolizumab、Nivolumab) 和 CTLA-4 抑制剂 (Ipilimumab) 等,获得美国 FDA 批准上市,核可的适应症多达十多种癌症,可望为癌症的患者带来新的契机。

PD-L1 和肿瘤基因突变负荷量 (TMB) 可能是评估免疫治疗的重要生物标记
Charles G. Drake 博士表示,近年来的临床肿瘤领域病理检验也开始将 PD-L1 在肿瘤的免疫组织染色 (IHC) 表现量视为重要的生物标记之一,目前已证实在头颈癌当中具有高度 PD-L1 表现的患者存活率明显低于 PD-L1 低度表现或未表现的患者,可将 PD-L1 的表现当作评估肿瘤预后的负面参考指标(Negative Prognostic Marker)。同时也有临床研究指出,若肿瘤组织具有高度表现的 PD-L1,癌症患者对于 PD-L1 抑制剂和 PD-1 抑制剂药物治疗的反应效果较佳,因此 PD-L1 也被视为评估是否采用免疫疗法的预测性生物标记 (Predictive Biomarker),但在不同的癌症种类上的预测效果并不一致,仍需要更多临床试验数据来佐证。

Charles G. Drake 博士
来自史隆·凯特琳纪念癌症研究中心 (Memorial Sloan-Ketterlin Cancer Center) 的 Timothy An-thy Chen 医师讲述,在评估免疫治疗的需要性时,肿瘤基因突变负荷量 (Tumor Mutation Burden, TMB) 可以视为一项重要的参考指标。根据一份第三期临床试验的数据显示,将非小细胞肺癌患者分为高肿瘤基因突变负荷量 (High TMB) 和低肿瘤基因突变负荷量 (Low TMB) 两组分别进行免疫治疗与化学治疗,高肿瘤基因突变负荷量 (High TMB) 组进行免疫治疗的无进展生存期(Progression-Free Survival,PFS)明显高于化学治疗,而低肿瘤基因突变负荷量 (Low TMB) 组的结果则完全相反,化学治疗的效果明显优免疫治疗。因此,美国 FDA 也已正式将 TMB 或肿瘤微卫星不稳定 (Microsatellite Instability High, MSI – H)列为重要的免疫治疗临床试验的重要参考指标。

Timothy An-thy Chen 医师
综观来看,容易因接触外在致癌物质导致高度基因突变的癌症种类,例如:吸菸可能导致的肺癌、头颈癌(口腔、食道、咽喉)、膀胱癌 和照射紫外光 (UV light) 可能导致的黑色素瘤 (Melanoma),接受免疫疗法的治疗效果普遍较佳。反之,若低度基因突变的癌症种类,则是选择标靶药物治疗 (Target Therapy) 或化学治疗 (Chemo Therapy) 较为合适。来自耶鲁大学医学院 (Yale School of Medicine) 的 Kurt A. Schalper 博士指出,由于近年来液态生物检体 (Liquid Biopsy) 和次世代定序 (NGS) 技术崛起,从患者血液当中的即可分析游离肿瘤 DNA (ctDNA),也能成为评估肿瘤基因突变负荷量的方法之一。

Kurt A. Schalper 博士
新的免疫检查抑制剂成为药物开发热门标的
免疫检查点抑制剂除了以常见的 PD-1、PD-L1、CTLA-4 为标的外,Timothy A. Yap 医师代表研究团队在 ASCO 大会上发表,近期有新的标的 ICOS (Inducible CO stimulator of T cell) 被发现也具有成为免疫治疗标的潜力,并且有代表性的药物 JTX-2011 已经进入临床试验阶段,将在第二期针对非小细胞肺癌、遗传性非息肉大肠直肠癌 (Hereditary Nonpolyposis Colorectal Cancer, HNPCC)、三阴性乳癌 (TNBC)、黑色素瘤 (Melanoma)、胃癌 (Gastric cancer) 等五项适应症进行临床试验,初次给予治疗的安全剂量约为 0.3mg/kg,目前已经有相当不错的数据结果。

Timothy A. Yap 医师
Rachel E. Shanborn 团队则发表,Anti-CD27 抗体 (Varlilumab) 与 PD-1 抑制剂 (Nivolumab) 合并治疗的研究,在大肠直肠癌和卵巢癌已顺利进行第一期和第二期临床试验,数据显示使用 3mg/kg 的 Varlilumab 为最适剂量,能有效辅助增强 PD-1 抑制剂 (Nivolumab) 的治疗效果。

Rachel E. Shanborn 团队
史丹佛大学医学院的 Branimir I. Sikic 博士发表 5F9 (Anti-CD47) 的研究结果,其团队发现 5F9 (Anti-CD47) 是锁定肿瘤细胞表面所表现的 CD47 为阻断目标,CD47 是肿瘤细胞为了躲过巨噬细胞(Macrophage)攻击,所释放的“不要吃我信号 (Don`t eat me signal)”,5F9(Anti-CD47) 可以阻断肿瘤的 CD47 表现抗原,让巨噬细胞可以正常辨认吞噬肿瘤细胞,相当有机会借此机转进行免疫治疗。
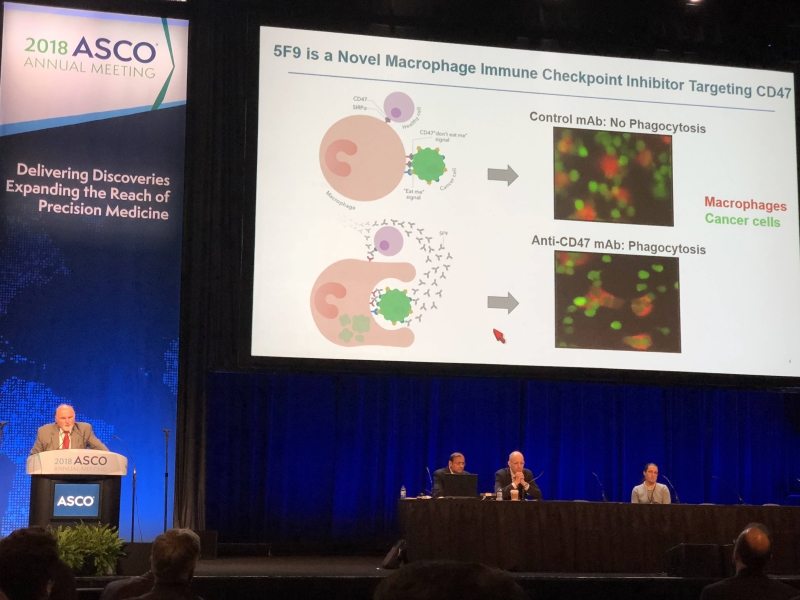
史丹佛大学医学院的 Branimir I. Sikic 博士
德州大学安德森癌症中心 (MD Anderson Cancer center) 的 Patrick Hwu 医师在演讲中总结,在当今与未来的临床癌症治疗要增进患者免疫反应可能有二大方向:(一) T 细胞免疫反应:免疫节点抑制剂(ex:PD-1、CTL4)、移植培养驯化后的 T 细胞 (ex:CAR-T) 或 增强免疫细胞激素 (Cytokines) 的正向讯号 (ex: NKTR-214 是 CD-122 的激活剂) 和细胞受器激活剂 (ex:JTX-2011 就是 ICOS 的激活剂)等。(二) 肿瘤微环境 (Tumor Microenvironment) 包括:抑制性蛋白质 (ex:TGF-β 的辅助) 或其他免疫细胞 (Treg、巨噬细胞)。

癌症免疫治疗小插曲 不良反应风险仍瑕不掩瑜
锡安山医学中心 (Cedars Sinai medical center) 的 Steven Hsiao 博士提到,免疫治疗的效果是受到肯定的,但也有可能造成一些意外发生,目前已知免疫治疗可能会产生心脏毒性 (Cardiac Toxicity) 的不良反应风险,但目前美国 FDA 和欧洲药物管理局都尚未对此提出警语。为了了解癌症免疫治疗后发生心脏毒性不良反应的风险有多高,他的研究团队着手进行一个涵盖 21,664 名患者的临床试验。其研究结果显示,单独使用 PD-1/PD-L1 阻断剂进行免疫治疗产生心脏毒性的风险极低 (仅 0.02%),但若将 PD-1/PD-L1 和 CTLA-4 阻断剂合并使用进行免疫治疗产生心脏毒性的风险将增加 7.42 倍 (0.13%),进行合并治疗 (Combined Therapy) 时应加以留意。
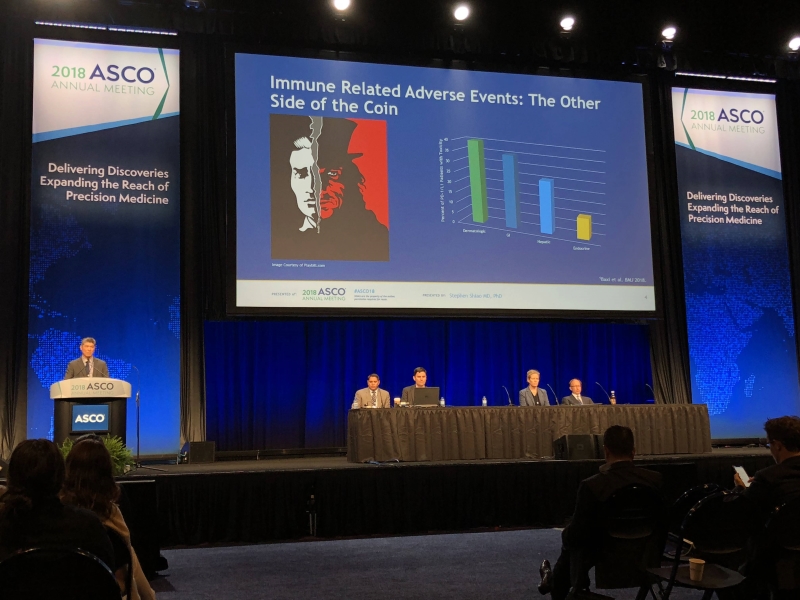
Steven Hsiao 博士
另外,他还提到近期有研究指出,肠道微生物的多样性会调控免疫系统进而影响到癌症免疫治疗和化学治疗的效果,他们蒐集了 38 名进行 PD-1 阻断剂治疗的患者粪便进行 16s RNA 序列分析,发现肠道菌多样性高的组别的存活率 (PFS) 明显高于多样性低的组别。但是,目前有 31% 的临床患者会使用抗生素 (Antibiotics),这会造成肠道菌的多样性和数量骤降,进而可能影响到癌症免疫治疗之成效,特别提醒在抗生素的使用上需要谨慎留意。
CAR-T 的下一步:挑战实质固态瘤之治疗
宾州大学的 Carl H. June 医师表示,癌症免疫疗法除了免疫检查点抑制剂外,嵌合抗原受体 T 细胞 (Chimeric Antigen Receptor T Cells, CAR-T) 也是一种非常热门且具潜力的治疗方法,是运用合成生物学 (Synthetic Biology) 或基因编辑 (Gene Editing) 的技术将癌细胞的 MHC 表面抗原 (身分证),利用改造的病毒外壳,把辨识肿瘤抗体片段送进 T 细胞内进行表现,再将这些驯化过的 CAR-T 细胞培养扩增后,回输到患者体内进行细胞治疗。CAR-T 细胞的来源包括:患者自己的 T 细胞、脐带血、健康的捐赠者、诱导性多功能干细胞 (Induced pluripotent stem cell, iPSC)等。他分享 2010 年,研究团队首次尝试为一位罹患急性淋巴性白血病(Acute Lymphoblastic Leukemia,ALL)的小女孩进行治疗,竟然完全治愈并健康存活至今,使得 CAR-T 的临床研究获得极大的关注,后续临床试验也非常顺利,并且在 2017 年成为全球第一个获得 FDA 许可上市 CAR-T 药物 (Kyrmiah)。

Carl H. June 医师
接下来值得探讨的问题是,CAR-T 是否能够在实质固态瘤 (Solid Tumors) 也能达到治疗效果? 因为血液肿瘤疗时,CAR-T 细胞能够在血液循环当中直接杀死癌细胞的效率极高,但若要将 CAR-T 细胞随着血液循环送到固态肿瘤,则还需要突破层层关卡,才可能达到治疗效果。宾州大学研究团队开始尝试将前列腺癌细胞模特有抗原 (Prostate-Specific Membrane Antigen ,PSMA) 和 TGF-β 的基因序列融合到 CAR-T 当中进行“武装”,在前列腺癌小鼠的动物实验已经显著看到治疗成效,目前正在进行第一期的人体临床试验 (#NCT03089203),结果相当值得持续关注。
文 / John Hung
延伸阅读:2018年ASCO现场报导(一): 推动人人受益的精准医疗<更多发烧议题 敬请期待 ASCO 系列报导>
©www.geneonline.news. All rights reserved. 基因线上版权所有 未经授权不得转载。合作请联系:service@geneonlineasia.com





