慕尼黑大學 (Ludwig-Maximilians-Universität, LMU) 的研究團隊近日於《Nature Chemical Biology》發表了一種能避免 DNA 損傷,且可重啟甲基化沉默基因的全新路徑。該研究的領導者 Thomas Carell 表示,這項機制有望成為未來重新編程 (reprogram) 幹細胞的工具,並替再生醫學開拓新視角。
從胚胎到成人-我們都深受 DNA 甲基化調控
DNA 甲基化係可藉由細胞分裂傳遞給子代的表觀遺傳標記,不僅穩定、更可如「記憶」般久存於人類基因體。DNA 甲基轉移酶 (DNA methyltransferase, DNMT) 是造成 DNA 甲基化的酵素,包括維持甲基化的 DNMT1 和建立甲基化的 DNMT3a、DNMT3b,其可控制特定組織於胚胎發育期之基因表現,並維持印痕基因 (imprinted genes) 的正確標記。近期研究指出,DNA甲基化和組蛋白修飾在誘導間質幹細胞 (Mesenchymal Stem cell, MSC) 分化為特定系統 (lineages) 的過程中扮演重要的角色。此外,目前的研究亦表明癌細胞表觀遺傳的改變主要起因於啟動子 (promotor) 的甲基化,導致關鍵抑癌基因 (tumor suppressor genes, TSGs) 表達沉默,最終引發癌症。
表觀遺傳調控的重要推手-甲基化胞嘧啶
綜觀而言,DNA 甲基化缺陷可能導致胚胎發育異常、癌症甚至影響基因印記,因此基因活化的調控必須為可逆反應,意即甲基化修飾能夠被移除或重新建立。組成 DNA 的四種基本結構 A、T、C、G中,胞嘧啶 (cytidine) 的甲基化對於基因活性的調節尤其重要,甲基團 (CH3) 一旦與胞嘧啶的第五個碳結合,基因活性將會被阻斷。就哺乳動物而言,胞嘧啶最主要的甲基化修飾型態為 mdC,mdC 經由 Ten-eleven translocation (TET) 蛋白的催化後,又可依據氧化程度的不同分為 hmdC、fdC 及 cadC (詳見圖一),這些氧化胞嘧啶的衍生物可在分離的神經組織及胚胎幹細胞之基因體中顯著測得,它們的表現水平則會隨著分化程度的不同而改變。
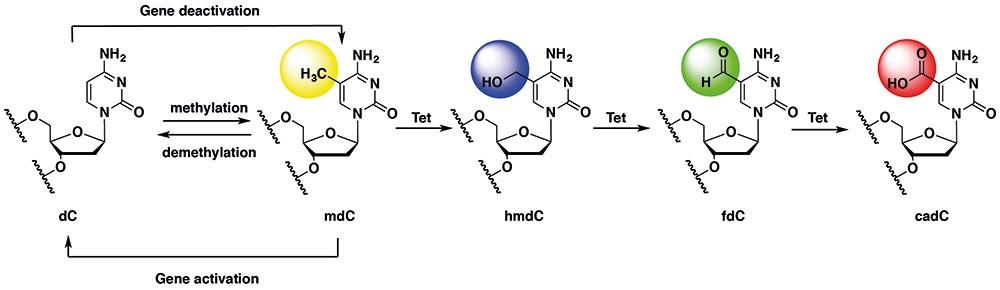
圖一、2’-deoxycytidine (dC)甲基化與 TET 蛋白介導之氧化反應
重啟基因表現-胞嘧啶的去甲基化
在上述不同氧化型態的甲基化胞嘧啶中, mdC 及 hmdC 是目前公認影響基因轉錄的關鍵分子,氧化程度更高的 fdC及cadC 則仍未知其確切功能。然而, fdC 及 cadC 是現今去甲基化反應中主要已知的中間產物,其係先藉由 thymine-DNA glycosylase (Tdg) 裂解 fdC及 cadC 上對應之糖苷鍵形成 AP 位點 (缺嘌呤/缺嘧啶位點),再經由鹼基切除修復 (base excision repair, BER) 機制促使未甲基化的 dC 取代 fdC及cadC。不幸的是,在這個反應過程中,移除每一個 mdC 皆會創造可能對細胞有害的單股斷裂中間體。
來自德國慕尼黑大學 (Ludwig-Maximilians-Universität, LMU) ,由 Thomas Carell 教授率領的團隊專精於 DNA 損傷及修復的研究,其近日發表於《Nature Chemical Biology》的著作首次揭開在活體中去除甲基化胞嘧啶更安全,且對細胞傷害更低的機制。他們在小鼠胚胎幹細胞中加入人工合成之同位素氟標定 fdC 衍生物 (synthetic isotope- and fluorine-labeled fdC derivatives),其在培養的過程中會嵌入細胞基因體做為標記,而後抽取 genomic DNA 再以極致效能液相層析串聯質譜儀 (ultra-high performance liquid chromatography coupled to tandem mass spectrometry, UHPLC–MS/MS) 檢測,發現同位素氟標定的 fdC 在嵌入基因體後,其鹼基會發生碳-碳斷裂而轉變為未甲基化的 dc (詳見圖二)。Carrell 指出,這個過程不僅不用倚賴 DNA 修復機制或 Tet 蛋白的輔助,又能避免形成潛在有害的無鹼基中間體,讓我們能在 DNA 結構不受破壞的情況下調控基因活性。
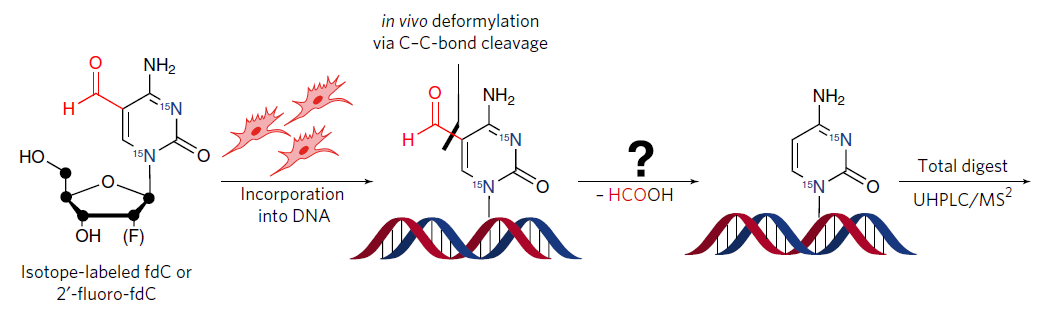
圖二、合成同位素氟標定之 fdC 衍生物嵌入小鼠胚胎幹細胞基因體後發生之碳-碳斷裂
表觀遺傳學是人類基因體研究中迅速發展的領域,目前已知許多人類疾病的生成皆與表觀遺傳修飾有密切的關係,如各種癌症、胚胎發育、神經學疾病、自體免疫、及呼吸道疾病等。本研究提出的碳-碳斷裂機制提供了一種安全,且可調控活體幹細胞特定基因的方法;隨著相關研究的發展,未來可望將表觀遺傳調控技術應用於再生醫學,為人類各種遺傳性及功能性疾病的治療帶來新希望。
文 / Angela Chang
延伸閱讀:間歇性斷食──啟動健康基因的開關參考文獻:
1. Katharina Iwan, et al. Nat Chem Biol. 2018 Jan;14(1):72-78. doi: 10.1038
2. https://www.nature.com/articles/498S10a
3. http://onlinelibrary.wiley.com/doi/10.1576/toag.12.1.037.27556/full
4. http://www.laboratory-journal.com/science/life-sciences-biotech/epigenetic-modifications-and-regulation-gene-expression
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com


