相较于双股螺旋 DNA,RNA 研究发展和新药开发的相关知识、技术则前进得较为缓慢。科学家于 1960 年代发现 mRNA)的存在,但是 RNA 编辑技术的应用一直到 1990 年代开始起步,直至最近 20 年间,RNA 相关的疫苗研发、新药开发、核准与上市才蓬勃发展。
尽管 DNA 编辑技术发展较成熟,但 DNA 编辑发生后就无法回复,是技术发展的一大限制。相较之下 RNA 编辑较具有可以修复的弹性,产生的不良反应也比较少。本期基因线上 GeneOnline 专题聚焦这项具有潜力的基因编辑技术,分别回顾 RNA 编辑技术发展历程、产业动态、专家访谈 3 大面向,深度介绍 RNA 编辑的发展进程。
延伸阅读:自然 RNA 修饰,基因检测的新兴潜力股!专访中研院庄树谆研究员话说从头:RNA 编辑的起源
RNA 编辑的起源,可以回溯到 1986 年单细胞原虫体内观察到的现象。Rob Benne 和几位科学家发表于《Cell》研究发现,原虫粒线体中转移突变的细胞色素氧化酶基因转录本,带有 4 个非由 DNA 编码来的外插尿嘧啶(Uracil)序列。他们于是把尿嘧啶的插入现象,也就是 RNA 在转录后修饰,使其与 DNA 序列不相应的机制,命名为“RNA 编辑”。
隔年,L. M. Powell 与另一批科学家很快就在哺乳类体内也发现类似的现象,甚至更为惊人:当 RNA 编辑将特定序列修饰为终止密码子(stop codon),RNA 小变动便会使其转译出截然不同的蛋白质。
自此,RNA 编辑被用于泛指 RNA 转录后的修饰机制,一般而言可依其运作方式分为两大类。第 1 类指 RNA 插入/删除(insertion/deletion)现象,此类编辑机制发生在转录形成成熟 RNA 以前,会更动基因组长度。第 2 类编辑机制则不会改变 RNA 总长,而是借由更动核酸的碱基对影响其后续作用。以上 2 类修饰都会与原始 RNA 模板产生不同的转译结果,也间接提高了生物的遗传多样性。
RNA 编辑机制一览:A-to-I、C-to-U 及其他
至于 RNA 编辑涵盖哪些机制,以下分别从 A-to-I、C-to-U 和其他两种衍伸类型,介绍 RNA 编辑的技术核心。
1. Adenosine to inosine(A-to-I)编辑
A-to-I RNA 编辑是由 ADAR 催化发生的反应。ADAR 辨识并解开双股 RNA 后,将腺苷(A)置换成肌苷(I),是生物体最主要出现的 RNA 编辑形式。
A-to-I 编辑是人体中最常见的 RNA 编辑机制,人体内这种基因编辑机制的作用目标是 Alu 元件(Alu element)。Alu 元件是一段特殊基因片段,它在人类基因体中高度重复出现,占据 11% 的基因片段,且人体全部 Alu 元件中至少包含 1 亿个 A-to-I 编辑位点,如果这些片段的 RNA 编辑功能异常会造成神经退化性疾病。
2. Cytidine to uridine(C-to-U)编辑
C-to-U RNA 编辑发生于单股 mRNA ,催化 C-to-U 编辑的酵素是 APOBEC,APOBEC 不仅执行 RNA 编辑,也会催化特定形式的 DNA 编辑。
最早在生物体内被发现的 C-to-U 编辑案例,与小肠载脂蛋白 apo-B48 和肝载脂蛋白 apo-B100 有关。这两种蛋白质分别在小肠与肝脏作用,但回溯到上游基因转录过程,两种蛋白源自相同的 DNA 序列,是因为转录过程的基因模板发生 C-to-U 编辑作用,才造成转译出两种完全不同的蛋白质。C-to-U 相较于 A-to-I 编辑在生物体内相当少见,但若功能异常,仍会导致严重疾病。

3. 应用 CRISPR-Cas 的 RNA 编辑技术(Cas-based ADAR)
Cas-ADAR 是一种结合 DNA 编辑与 RNA 编辑的技术,它的原理是透过执行 DNA 编辑的 Cas9 蛋白,和单股导引 RNA(sgRNA)结合,再去编辑目标 mRNA。这项技术的好处是既能表现 DNA 编辑的高编辑效率,也能顾及 RNA 编辑低脱靶效应(off-target)的优点。
Cas-ADAR 与目标 RNA 的结合力相当高,近几年有研究便透过以 RNA 为标的的 Cas9(RCas9)技术,修复小鼠体内导致肌肉强直症(myotonic dystrophy)基因。
4. PPR 编辑技术
Pentatricopeptide repeat (PPR)蛋白广泛存在植物体内,它会结合植物粒线体或叶绿体的基因转录本,修饰其 RNA 序列进而影响植物的光合作用、呼吸作用等功能,这类蛋白的潜力也被应用至 RNA 编辑技术领域。
在人类现有疾病中,约有 15% 和 RNA 编辑异常功能有关,非编码 RNA 的基因活性失调更是许多疾病的起因,PPR 正好能在其精准编辑的特性上补足临床应用的需要。
已有研究在人类与小鼠模型中透过 PPR 蛋白修饰与眼部和神经疾病相关的 RNA,将来可能作为老年性黄斑部病变的治疗方式。此外改良的 PPR 编辑技术也可引导 RNA 转录本在细胞内定位,以提升读取 RNA 转录本产出蛋白质的效率。
各有千秋:RNA 编辑 vs. CRISPR
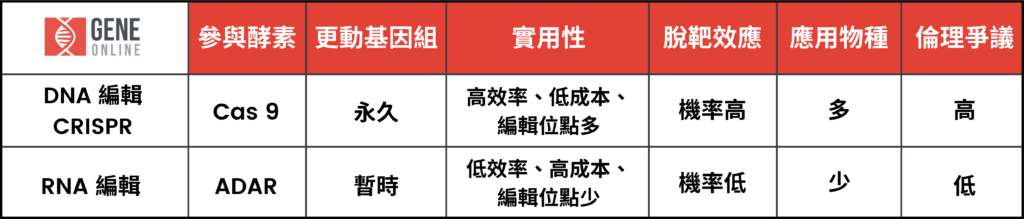
回到基因编辑的技术发展史,不能不提到 DNA 编辑的霸主 CRISPR。简单而言,它的原理是透过人工改造形成的单股导引 RNA 与 Cas9 蛋白作用后,在 DNA 序列上执行定点切割。
CRISPR 最大技术问题便在于,对基因组造成永久的更动,所造成后续效应不论在生物体本身或者伦理层面都引发相当争议。
相较之下,尽管 RNA 编辑技术成本较高,编辑效率不如 CRISPR 高与应用广泛,但 RNA 编辑仍是基因编辑界可瞩目的新星。其转录后修饰机制并不会对基因组造成永久性的更动、产生脱靶机率较低、适合在体外进行、再加上参与蛋白 ADAR 是人体本身就带有的酵素,不容易引发免疫系统激烈反应,都是 RNA 编辑应用上明显具有的安全优势。下一篇将延续从 RNA 编辑的产业概况,进一步介绍 RNA 编辑的市场应用趋势。
参考资料:
1. Cell, 1986; https://pubmed.ncbi.nlm.nih.gov/3019552/
2. Cell, 1987; https://pubmed.ncbi.nlm.nih.gov/3621347/
3. Journal of Translational Medicine, 2019; https://translational-medicine.biomedcentral.com/articles/10.1186/s12967-019-2071-4
4. Reference Module in Biomedical Sciences, 2019; https://www.sciencedirect.com/science/article/pii/B9780128012383113649
5. Cells Reports, 2020; https://www.sciencedirect.com/science/article/pii/S2211124720313395
6. https://www.nature.com/articles/d42473-019-00327-w
7. https://www.nature.com/articles/d41586-020-00272-5
©www.geneonline.news. All rights reserved. 基因线上版权所有 未经授权不得转载。合作请联系:service@geneonlineasia.com