肠道微生物帝国的盛衰
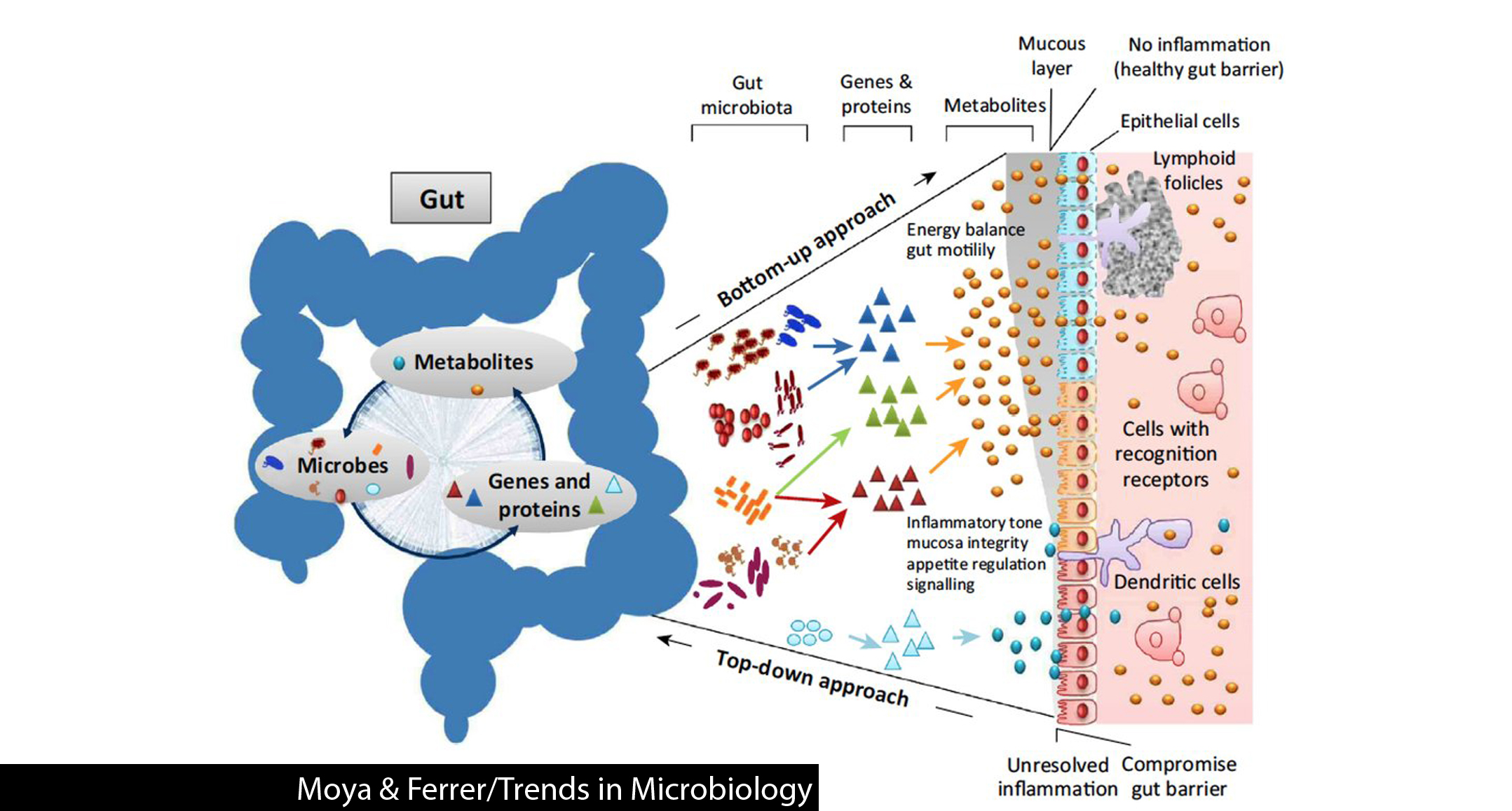
人体大概由 10 的 13 次方个细胞组成,但共生的细菌却有 10 的 14 次方个以上;人体约有 22,000 个基因,但光是肠内共生细菌不重复的基因子总和就高达 3,300,000 以上;不同人之间基因体相似度接近 99.9%,但彼此肠道内微生物种类的相似程度竟只有 10-20%。不过这些数据大多来自西方国家,究竟能否代表全人类乃是一大问题。为解开此疑惑,意大利的一组研究团队千里迢迢前往西非洲的布基纳法索,比较当地青年住民与意大利佛罗伦斯儿童粪便内的微生物。研究结果显示,长期摄取西式饮食可能导致肠内微生物的种类逐代减少。布基纳法索青年以小米、蜀黍等高纤食物为主食,而意大利儿童长期食用高蛋白与精致淀粉食品,结果前者不论在菌种丰富度或是数量都明显高于后者,肠道菌产生的抗发炎物质含量也较高。从过去的研究已经知道肠道微生物与人体的免疫系统、消化、以及解毒作用息息相关,有些微生物更能分解人体无法消化的物质来帮助吸收,甚至制造日常所需的维生素。这项研究的结论是,西方国家的“健康”肠道微生物菌相其实可能已弱化许多,若以此作为基准,恐会造成我们误判肠道微生物的种类和比例对健康的影响。因此在探讨肠道微生物的任何作用之前,目前有必要针对全球各种族群大量采样,才能对肠道微生物的本质有比较完整的认知。
为帝国把脉:肠道微生物的内忧外患?
进驻布基纳法索的研究团队推论肠道微生物演化的差异是饮食习惯所造成。为验证此理论,美国史丹佛大学的研究团队分别喂两组小鼠高纤食物以及西式高糖、低纤食物后,发现接受西式低纤饮食的小鼠,其肠道微生物的丰富程度会逐渐减少;不过后续若再给予一阵子高纤饮食,则肠道微生物的丰富度会再度上升,只是没办法恢复到最初的状况,更无法达到原先就摄取高纤饮食的小鼠之微生物丰富程度。最震撼的是,研究团队设计了一个多代实验,让母鼠持续进行西式低纤饮食直到其子代断奶后,才切换至高纤饮食,于是子代都在母体肠道微生物数量低下的状况诞生并渡过母乳依赖期;实验持续进行到第四世代,结果每代出生的小鼠之肠内微生物丰富程度愈来愈低。在上一代已经势单力薄的菌属,甚至没有办法传到下一代。此外,母鼠即使后来摄取高纤饮食,肠内微生物的丰富度也不会再增加。这说明母体内微生物数量若是太低,其子代可能连一点都拿不到,导致后天就算进行饮食调控也没办法无中生有。
在人类身上是否也能观察到类似的肠道微生物变化?另一项研究找来 10 位自愿的受试者并分成两组,连续五天限制他们只能吃研究团队给予的食物。其中一组的早餐是培根加蛋,午餐吃肋排与鸡胸肉,晚餐吃意大利蒜味香肠与各种自选的起司;另一组的食物则是以全麦、豆类、蔬菜、与水果为主的高纤饮食。研究者在试验前、中、后收集受试者的粪便样本分析后发现,食物到达小肠后短短一天之内,肠道微生物的种类和数目会根据摄取的食物而有所增减:肉食组受试者肠道内能够耐受高浓度胆汁的菌种显著增加,与分解蛋白质相关的基因活性也有所提升;而蔬果组受试者则是消化碳水化合物相关的基因活性明显提升。从此研究可知道食物确实能影响肠道微生物的平衡,再加上前面所提之代代相传现象,或许正是西方族群肠道微生物种类贫乏的肇因。
寻找治国良方:恢复肠道微生物的健康平衡
要是食物能够影响肠道微生物,那直接吃下有益人体的微生物是不是更能直接发挥作用呢?其实中国古代典籍《唐草本》以及明朝李时珍著名的《本草纲目》,均有以“人中黄”,也就是粪便萃取物来治病的记载。而在 1950 年代,当时美国因为院内金黄色葡萄球菌 80/81 型肆虐,所以外科医师从手术前便开始使用抗生素到患者出院;但是这会造成患者出现腹泻、胀气、以及明显全身不对劲的情形,而且会使粪便于术后几天培养不出细菌,甚至连异味都没有。为重建患者被抗生素摧毁的肠道微生物群集,当时一位年轻的医检师 Stanley Falkow (现为著名微生物学家) 与 S 医师便在患者入院时就收集其粪便并分装于 12 颗胶囊内冰存;待患者出院时嘱咐他们一天服用两次,每次两颗 (患者并不知道内容为何),并配合生菜沙拉服用。根据记载,“自体粪便沙拉”的确较传统处置更能改善患者术后的不适,突显“自体粪便移植”的临床应用价值。不过由于这项“跨界合作案”不久就被医院上司发现,此系列非正式临床试验马上就被迫中止且 Falkow 也被开除 (但两天后旋即被重新雇用)。
后来虽然陆陆续续也有使用粪便治疗成功的报告,但直到 2013 年才出现第一个与抗生素做比较且设计完整的临床试验。试验目标是 Clostridium difficile (困难梭状芽孢杆菌),此菌会造成胃肠道感染,某些高风险患者往往因抗生素效果不彰而会反复感染。于是该试验将这类反复感染患者分为三组:一组在给予万古霉素 (强效抗生素) 后进行洗肠,接着以鼻 – 十二指肠管将健康捐赠者提供并经过特殊调配而成的粪便溶液输注至肠道;另一组就只给予标准万古霉素疗程;第三组则在万古霉素疗程后加上洗肠,但未输注特调粪便。结果发现 81% 接受粪便溶液输注的患者在治疗后10周内都不再复发感染,66% 发生复发的患者经过输注来自其他健康捐赠者的粪便溶液后也能达到治疗目标。其他两组的治疗成效就明显较差 (分别只有 31% 与 23% 达到治疗目标),因此这项试验成功验证了粪便治疗的可行性。

Stanley Falkow,来源:https://med.stanford.edu/news/all-news/2015/12/stanley-falkow-to-receive-national-medal-of-science.html
不过直接吞粪便胶囊或以粪便溶液进行灌注毕竟还是有点恶心,因此美国 Seres Therapeutics 便选取可能有疗效的粪便菌种之孢子制成 SER-109 胶囊,用来治疗 Clostridium difficile 反复感染。在2014 年,SER-109 在 Phase Ib 临床试验中成功治疗 29 位这种患者 (总试验人数为 30 位);而从微观层面分析,患者服药后仅需四天就能观察到肠道微生物丰富度显著提升,且持续时间更长达 24周。这耀眼的成绩单让 SER-109 得以在 2015 年进入美国 FDA 的加速认证程序 (breakthrough status)。但就在一切看似顺遂,即将刻下人类医学里程碑的时候,2016 年粪便疗法界第一个设计严谨的 SER-109 Phase II 双盲临床试验却在解盲后宣布失败,意味着药物其实不具疗效。虽然事后检讨报告提到确实有看到患者肠道微生物丰富度提高,但可能因疾病诊断不够精确,加上给予剂量较 Phase Ib 时低等因素,才导致成果未达统计上的意义。不过这并未浇熄各界对粪便治疗的热情。非营利组织 OpenBiome 乃是美国第一家粪便银行,创办人因为亲友反复发生 Clostridium difficile 感染且抗生素治疗效果不彰,四处寻求解决办法后,好不容易才用粪便移植重新找回人生。但因为整个过程实在太过艰辛,于是他们成立 OpenBiome,希望能够推广该治疗并同时研发更便利与有效的制剂。目前该组织也有运用自家特有技术研发的产品在进行临床试验,期望使粪便治疗的领域延续并进一步扩大。
结论:治国要有多方考量,回归原始受益良多
肠道微生物和人体健康的关系密不可分,但从上述例子看来,目前人类对其中复杂的机制仍是一知半解。或许我们不能只着眼于微生物的数目和种类,而必须以类似“生态圈”的观点切入;且分布于肠道内的各种化学物质及粪便极可能也扮演不可或缺的角色,制作药物时也应该考虑在内。总结来说,短时间内虽然还无法实现直接以肠道微生物入药进行改善,但是摄取多元食物并秉持高纤、多蔬果、多健康发酵食品 (如优格、泡菜、味噌等) 以及少肉、少加工食品的原则,绝对还是维护肠道微生物与健康的正道。
延伸阅读:新药开发的漫“肠”旅途-肠道菌相关公司大点名©www.geneonline.news. All rights reserved. 基因线上版权所有 未经授权不得转载。合作请联系:service@geneonlineasia.com
首图来源:
https://healthhacker.me/category/probiotics/