全球科技領域正迅速發展,隨嵌合抗原受體 T 細胞的問世,也成功推動製藥產業轉變,從傳統藥物發展擴展至細胞療法此新興科技。經過過去數十年的耕耘,細胞治療已在多項疾病治療中取得重要進展,如包含癌症、神經退化性疾病、心臟病、慢性代謝疾病治療,與再生醫學應用等。全球預估 2050 年再生醫療市場產值達 3,800 億美元,異體細胞製造因可提升細胞生產量能,以達成現貨即用之理想營運模式,使其成為未來治療的潛力龍頭。
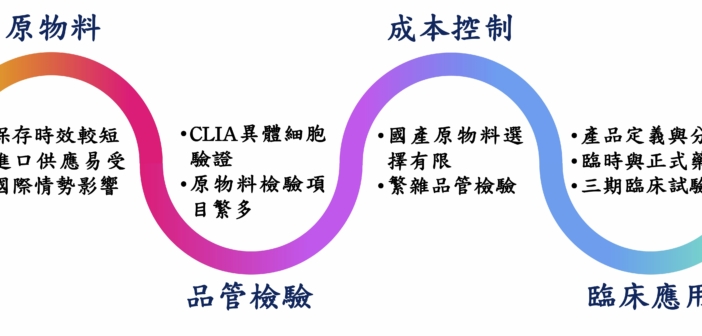
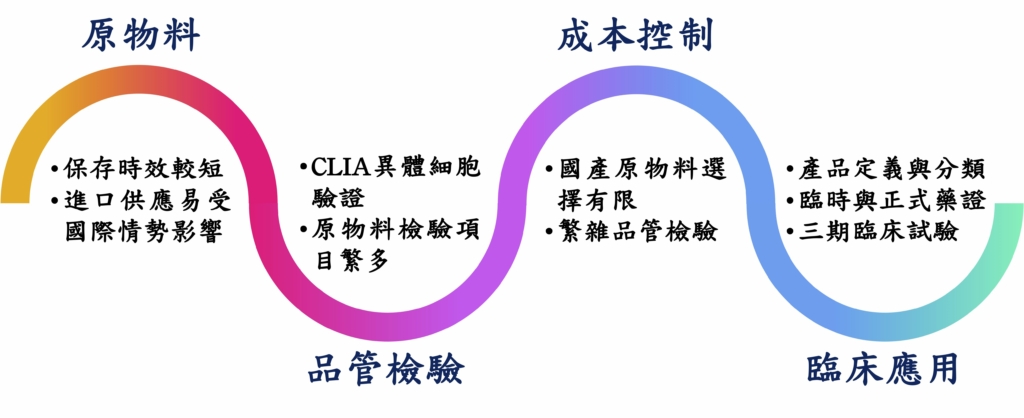
然而,異體細胞製造技術門檻較高,且細胞保存挑戰愈加明顯,同時提升相關品管規範與法規建立之難度,相關挑戰項目如圖 1 所示。可以說,細胞治療的監管是一場複雜的平衡遊戲,需同時考量創新與安全性兼具,加上各國目前於法規與標準要求存在差異,且面對新興治療規範擬定,在科技發展迅速時空背景下,法規難以及時更新,這不僅對於細胞製造產業與研究機構築起層層挑戰外,也可能導致無法有效於未來迅速對於先進醫療技術進行臨床轉譯。除此之外,由於細胞治療產品多樣性,有時難以區分不同類型,在產品定義和分類上也為一大問題。此外,細胞治療產品的臨床試驗和批准過程也面臨挑戰,由於不同產品各有專屬性質,需要制定特殊的臨床試驗設計和安全監測計劃。同時,監管機構可能需要更多時間來評估和批准細胞治療產品,這可能導致患者面臨延誤。在這樣的環境下,建立靈活的法規體系將對台灣的企業在國際市場上更具競爭力並推動本地產業長期成長至為關鍵。
今(112)年,在經濟部產業技術司支持下,資策會科法所針對我國細胞產業相關法遵議題,特別結合結合長期投入細胞治療研究領域、積極衍生在地產業的「中亞聯合大學系統」,進行深入研析與產學研專家訪談。結果發現產業面臨為確保細胞製劑產品的品質、安全性和有效性,在繁瑣的製造標準和品質控管機制下將顯著提高法規遵循的複雜度,也墊高細胞製劑的生產成本。
在原物料品質管控方面,儘管先進國家已發布多項相關指引,且我國目前主要參照國際醫藥法規協和會(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)的指引,建立品質控管機制。然而,由於我國尚未有明確指引,主管機關和廠商對國際指引的解讀可能存在分歧,增加了案件申請的難度。此外,目前主要的細胞新藥生產原物料主要依賴國外進口。雖然國內部分廠商有生產關鍵原物料(如培養基、血清)的能力,但由於尚未有臨床使用的經驗,使其未能融入國內細胞製造供應鏈。在全球原物料供應受到疫情嚴重影響的情況下,進口原物料的短缺迫使細胞製造場面面臨是否需要進行原物料與製程變更的困境。儘管目前可以透過資料數位化和系統建立來縮短審查和變更資料傳遞的時程,但針對原物料和製程的重大變更申請,廠商需要面臨不亞於新案審查的審查工作。雖然目前尚無國際指引對此提供適當建議,但鑒於細胞新藥原物料來源有限且高度仰賴進口,廠商期盼主管機關能至少先建立具體的審查機制,並在發展細胞新藥產業的過程中考慮支持本土原物料的生產能力,以確保細胞新藥產業的持續發展和國際競爭力。
表1 我國細胞治療法遵議題與挑戰
| 項目 | 說明 |
| 原物料 | 細胞培養所用關鍵原物料(如血清、培養液、生長因子等)保存期限較短,提升細胞製造供應鏈運作難度。多數原物料需仰賴進口,供貨狀況易受國際情勢變化影響。當發生時,製造商須申請原物料或製程變更。 |
| 品管認證 | 為嚴謹控管異體細胞之合適性與安全性,來源細胞可能需同時經過 ISO15189 與臨床實驗室改進修正案合規之單位檢驗。然而,全球驗證單位有限,認證流程曠日費時。相較於傳統小分子藥物,細胞製劑製程所需關鍵原物料多元,部分生物成分原料保存不易,品管需檢驗項目繁雜。單一檢驗單位也難以提供全面驗證服務,提升品管執行所面臨挑戰。 |
| 成本控制 | 國內原物料供應選擇有限,且目前處萌芽階段,故目前需仰賴進口原物料,除降低製劑供應鏈穩定性外,原物料成本也因市場規格而難以優化。雖藉異體細胞的使用可放大細胞製劑產量,但細胞可放大次數有限,故須持續收集並申請驗證,以維持細胞庫存量,也進而提升製造成本。 |
| 臨床應用 | 全球細胞治療產業發展迅速,我國產業除可透過開發與生產製造服務加入國際賽局外,如何發展自有特色之細胞新藥產品,為提升我國產業競爭力之重要課題。新法關於危及生命或重大失能疾病之製劑藥證申請與適用時間點需更加明確定義,且部分特管法規範內之細胞治療項目是否可適用此條款(如纖維母細胞、軟骨細胞等)有待商榷。為確認細胞製劑安全性與有效性,細胞產品須經第三期臨床試驗驗證,門檻極高。這將會降低產業投入開發意願,同時可能會限縮細胞治療於臨床發展方向與創新。 |
全球各國積極參與發展細胞治療使得醫學發展邁向嶄新里程碑。然而,尚存許多法規和監管挑戰仍需克服,需建立靈活法規體系,以促進創新並確保產品品質。台灣在這領域取得進展,但仍須面對原物料供應的挑戰。期望未來主管機關能更有效地支持本土產業,以確保細胞治療領域的可持續發展並提高國際競爭力。
撰文/亞洲大學 蘇文郁博士/助理教授、沈育芳博士/副教授、何佳哲博士/副教授、王昭能博士/副教授
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com