阿斯特捷利康(AstraZeneca, AZ)近期公布第三期試驗 CAPItello-291 結果,顯示旗下藥品 capivasertib 合併 fulvestrant (Faslodex) ,相較於安慰劑合併 fulvestrant ,針對在接受內分泌治療(合併/不合併 CDK4/6 抑制劑)期間復發或之後惡化,晚期(無法手術)或轉移性 HR 陽性、HER2-low 或陰性乳癌病人,能明顯改善無疾病惡化存活(progression free survival, PFS)。
羅氏新核准的伴隨性診斷能為 HER2-low 患者提供治療選項(基因線上國際版)晚期 HR 陽性乳癌治療選項有限
乳癌是最常見的癌症,也是佔全球癌症死亡的主要原因之一。根據統計, 2020 年全球超過 200 萬病人被診斷出患有乳癌,近 685,000 人因此死亡。
Hormone receptor (HR) 陽性乳癌(單一雌激素 [ER] 或孕激素受體 [PR],或兩者一起表達)為最常見的乳癌亞型,大約有 70% 的乳癌腫瘤被認為是 HR 陽性和 HER2-low 或陰性。 HR 陽性乳癌細胞的生長通常由雌激素受體 (ER) 驅動, 而針對 ER 驅動疾病的內分泌治療目前被廣泛應用於晚期癌症治療,並且通常會合併 CDK 4/6 抑製劑。 然而,許多晚期病人會對 CDK4/6 抑製劑和當下所接受的內分泌治療產生抗藥性。 一旦發生這種情況,治療選項就會變成有限(化療可能是唯一選擇 ) 並且存活率很低。 如何在治療階段性優化內分泌治療和克服病人的抗藥性,是目前乳癌研究的重點領域。
Capivasertib 可望治療所有 AKT
Capivasertib 是一種研究中口服治療新藥,目前正處於治療多種乳癌亞型、前列腺癌的第 III 期試驗以及血液腫瘤的第 II 期試驗中。 AKT,是在如葡萄糖代謝、凋亡、細胞增殖轉錄及細胞遷移等多種細胞過程中起到重要作用的一種絲氨酸/蘇氨酸(serine/threonine) 激酶。而此次研究中的 capivasertib 是一種針對現有三種 AKT 亞型 (AKT1/2/3) 的選擇性 ATP 競爭性抑製劑,目前正評估其作為單一治療或聯合現有治療之療效,用於經 AKT 途徑 (PI3K/AKT/PTEN) 生物標記改變的腫瘤,亦或是依賴該途徑的信號傳導而生存的腫瘤。此外,capivasertib 400 mg 依照四天停三天的間歇給藥方案, 給藥時需一天給藥兩次。
CAPItello-291 第三期臨床試驗顯示可降低疾病惡化及死亡風險
CAPItello-291是一項第三期、雙盲、隨機分派試驗,主要評估 capivasertib 合併 fulvestrant 相較於安慰劑合併 fulvestrant 治療局部晚期(無法手術)或轉移性 HR 陽性、HER2-low 或陰性乳癌病人的療效與安全性。
該試驗共招募全球 708 名經組織學證實為 HR 陽性、HER2-low 或陰性乳癌的成年病人,皆為接受芬香環轉化酶抑制劑(aromatase inhibitor)且合併或不合併 CDK4/6 抑製劑治療期間或之後疾病復發或惡化,以及針對晚期階段接受過多達一線化療的病人。 納入試驗的病人中約 40% 為AKT 途徑中生物標記 (PI3K/AKT/PTEN) 改變的群組。此試驗的主要評估指標為整體病人群以及經 AKT 生物標記改變的病人群之疾病惡化存活率。
結果顯示,在整體病人群中, capivasertib 合併 fulvestrant 組相較於安慰劑合併 fulvestrant 組,無論是無疾病惡化存活率或是死亡風險皆降低 40%(風險比 [HR] 0.60,95% 信賴區間 [CI] 0.51- 0.71;p <0.001),兩組中位數無疾病惡化存活期為 7.2 個月對照 3.6 個月,皆達統計上顯著差異。 而在 AKT 生物標記改變的病人群中,相較於安慰劑合併 fulvestrant 組,capivasertib 合併 fulvestrant 組更是降低無疾病惡化存活率或死亡風險 50%(HR : 0.50,95% CI 0.38-0.65;p=<0.001),兩組中位數無疾病惡化存活期為, capivasertib 合併 fulvestrant 組 7.3 個月以及安慰劑合併 fulvestrant 組 3.1 個,亦達統計上顯著差異。(見圖一)
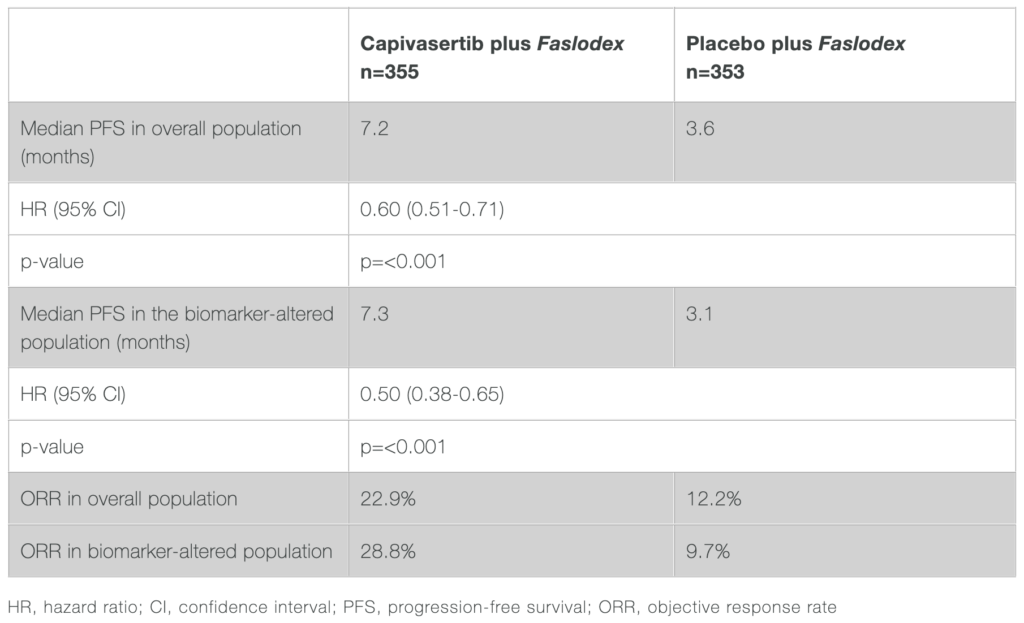
另外,在整體病人群中,capivasertib 合併 fulvestrant 組之客觀緩解率 (objective response rate, ORR) 為 22.9%,安慰劑合併 fulvestrant 組為 12.2%;而在生物標記改變的病人群中則分別為 28.8% 和 9.7%。 雖然整體存活 (overall survival, OS) 數據在分析時尚不成熟,但這些早期數據結果仍令人鼓舞,該試驗將繼續評估 OS 當成關鍵的次要評估指標。
在安全性評估上,capivasertib 合併 fulvestrant 組與之前評估該組合的試驗所觀察到的相似。 在整體病人群中,capivasertib 合併 fulvestrant 組最常見的任何級別不良反應 (AE) 為腹瀉 (72.4%)、噁心 (34.6%)、皮疹(38%)、倦怠 (20.8%) 以及嘔吐 (20.6%)。 而發生 3 級或更高級別的不良反應分別為腹瀉 (9.3%) 以及皮疹 (12.1%)。
上述試驗結果將發表於 2022 San Antonio Breast Cancer Symposium (SABCS) 乳癌研討會中。
延伸閱讀:跟時間賽跑!基因檢測降低乳癌治療試錯、提升治療成效參考資料:
https://clinicaltrials.gov/ct2/show/NCT04305496
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com