過去二十多年間,製藥產業無不致力於探索轉移性癌症的治療方法。然而,癌症藥物研發失敗率竟高達 95%,這凸顯儘管在臨床前擁有高潛力的藥物,經過實際的臨床試驗後,常常帶來令人大失所望的結果。加上腫瘤學藥物的臨床試驗成本皆特別高昂,失敗意味著基礎研究專家、臨床醫護人員,甚至是可能接受無效或有毒治療的患者,都將損失寶貴的治療時間、耗費巨額資金,並且嚴重磨耗病患對於康復的希望,這些因素都令問題雪上加霜。
2023 年 ASCO 年會:實體腫瘤治療研究的進展(基因線上國際版)藥物研發之路難關重重
藥物研發通常包含四個階段:研發與探索、臨床前動物試驗、臨床試驗以及新藥審查和登記。成功開發一款藥物至少需要耗費 10 至 15 年,成本更可能高達數十億美元。然而即便花了大量的資金及時間成本,多數研究常常以臨床試驗階段失敗告終,更遑論能夠成功通過新藥審查並且登記在案僅約 9.6%。藥物開發所面臨的高失敗率,可能肇因於開發過程過度強調藥物效能,進而忽略其他重要因素,導致臨床療效不彰,也因為毒性和副作用難以控制而衍生安全風險。
除了在藥物應用層面的困難,藥廠同時也面臨多重難關,例子包括新藥開發過程所帶來的沉重財政壓力。當成功研發出能夠完全治癒疾病的藥物時,患者可能不再需要後續的服務,進而對藥物產業的商業模式帶來挑戰。這些困難可能是導致「藥荒」現象的原因之一。今年六月,美國食品藥物管理局(Food and Drug Administration,FDA)的一位代表透露,目前全美至少有 14 種用於癌症治療的藥物出現供應短缺的情況。在這些藥物中,Intas Pharmaceuticals 是主要的供應商之一,然而該公司目前因生產線的暫時關閉而導致供應不足。
揭示癌症藥物開發挑戰,從 IGF-1R 抑制劑失敗中汲取教訓
發表在網路開放期刊《JAMA Network》上的最新研究估計,每年針對腫瘤藥物開發失敗造成的花費高達 500 億至 600 億美金。這項橫斷研究(Cross-sectional study)以 16 種胰島素樣生長因子 1 受體(insulin-like growth factor 1 receptor,IGF-1R)抑制劑為例子,當中涉及 183 項臨床試驗,涵蓋 12,000 多名癌症患者。然而沒有一種藥物獲批准用於腫瘤臨床實踐,估計這些試驗的費用超過 16 億美元。
從 IGF-1R 抑制劑計畫的失敗中,可以歸納三個值得借鏡的層面。首先,藥物進入臨床試驗階段前必須具備更為扎實的研究證據,以確保其可行性的基礎。這包括對臨床前模型的評估,以及候選藥物(candidate)在模型中應達到的標準。其次,在投資時建議保持技術的多樣化,避免過度集中於特定層面(例如 IGF-1R),而忽略其他重要因素。最後,缺乏嚴謹的分析可能是造成臨床試驗失敗的原因。
STAR 系統:平衡藥物開發,創造臨床成功契機
臨床藥物開發的成敗取決於最佳候選藥物的選擇、臨床劑量、藥物療效與毒性之間的協調平衡,而藥物的靶點也需要進行相關的驗證研究。由密西根大學研究團隊提出的一套系統 STAR (structure‒tissue exposure/selectivity–activity relationship)能夠權衡構成最佳藥物的各項因素,協助研究人員擬定更好的研發策略。此系統將同步考量常被忽略的藥物組織暴露(tissue exposure)和選擇性(selectivity),與藥物的效價(potency)和特異性(specificity)。這也意味藥物不僅能夠準確地作用於目標,還能在體內輸送至受影響的組織,以實現精準治療的效果。
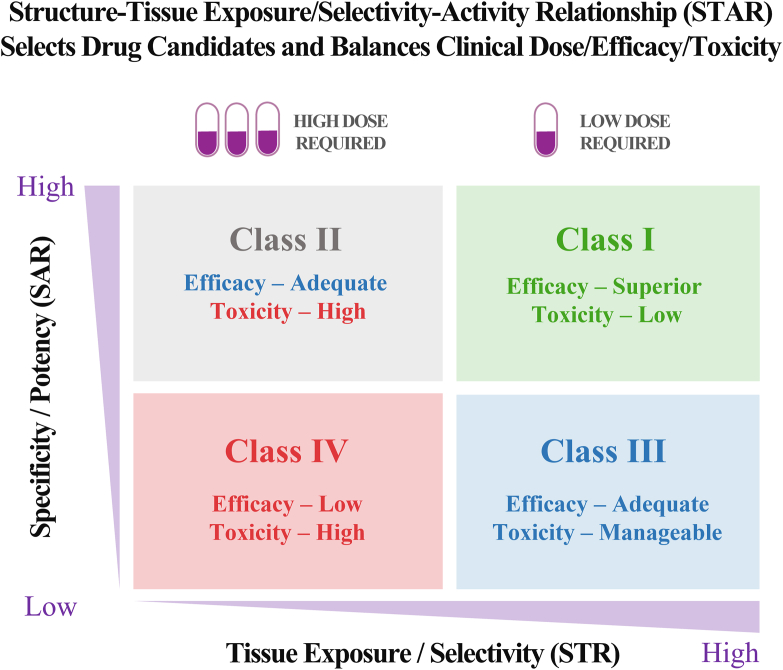
STAR 系統將藥物分為四類,分別訂定推薦劑量。在藥物進行後續測試之前,不同類別的藥物將需要採用不同的優化策略。第一類候選藥物只需要低劑量便能最大化功效與安全性,屬於最理想的藥物選擇,也代表具有高機率能夠持續研發。第二類候選藥物需要較高的劑量才能夠達到足夠的功效, 但也可能因此導致難以控制的毒性,若要作為候選藥物則需要謹慎評估才能再推進。
第三類候選藥物則僅需要較低至中等的劑量就能達到足夠的功效以及可控的毒性,儘管這類藥物具有較高的臨床成功率,卻也是經常被忽視的一群。第四類候選藥物不僅功效不足甚至還有較高的毒性,是需要立即停止開發的候選藥物。
展望腫瘤藥物開發,追求未來治療希望
在藥物開發中,失敗將帶來不容忽視的龐大損失。為了減少損耗,需要加強靶點的驗證,採用更適切的臨床前模型,並在進行臨床試驗之前做出更完善的決策,並據此提高資源的利用效率。
面對藥物開發失敗率極高的難題,我們必須回歸踏實的科學驗證與持續不懈的投入以開創更多的可能性。期盼研究人員、臨床醫護專家與藥廠等各方攜手合作,持續不斷地探索和創新,找到更有效的治療方法,從而提升患者的生活品質。
延伸閱讀:去中心化臨床試驗成疫後趨勢,美國 FDA 公布草案徵求建議參考資料:
1.https://www.cbo.gov/publication/57126
2.https://theconversation.com/90-of-drugs-fail-clinical-trials-heres-one-way-researchers-can-select-better-drug-candidates-174152
3.https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2807710
4.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9293739/
5.https://www.mohw.gov.tw/dl-14742-815cec17-0354-48ed-9bbe-5d5138303528.html
6.https://www.moea.gov.tw/MNS/doit/industrytech/IndustryTech.aspx?menu_id=13545&it_id=6
7.https://www.cnbc.com/2023/06/01/cancer-drug-shortage-fda-mulls-overseas-chemotherapy-imports.html
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com