1 月 30 日,美国 FDA 宣布核准 Stemline Therapeutics 公司的乳癌新药 Orserdu(elacestrant),为第一款、也是唯一一款用于带有 ESR1 基因突变的 ER+, HER2- 晚期或转移性乳癌病人药物。Stemline Therapeutics 隶属意大利第一大药厂集团 Menarini Group,Menarini 于 2020 年收购该公司便是锁定其拥有的含盖乳癌、 多发性骨髓瘤等癌症的多样产品线。
针对 ESR1 突变的晚期乳癌贺尔蒙治疗
晚期乳癌药物研发可以说是近年国际药厂的兵家必争之地,依据不同的基因突变分型确立乳癌诊断与治疗指标的趋势也越加成为主流。回顾去年 FDA 的重大核准案件中,即有针对 HER2 低表达转移性乳癌的 Enhertu 获准,其不仅是首支针对 HER2 低表达乳癌族群的标靶治疗,更有着重新定义乳癌亚型的指标意义。
据统计美国每年约有 300,000 名乳癌新确诊病人,每年超过 43,000 人死于晚期转移性乳癌。常见 ER+、HER2- 晚期或转移性族群中约 40% 带有 ESR1 变异,而 ESR1 变异已知与病人对标准贺尔蒙疗法产生抗性有关。Stemline 刚获核准的 Orserdu 新型荷尔蒙口服药物,用于至少接受过一线贺尔蒙药物、带有 ESR1 (estrogen receptor alpha gene 1)突变的晚期乳癌病人。
晚期乳癌与 ESR1 突变次族群 PFS 显著改善
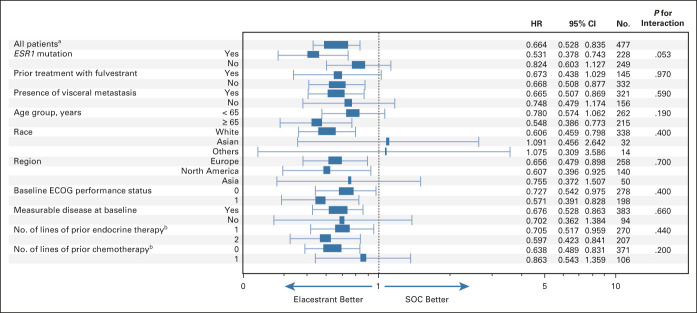
第 3 期 EMERALD 是一项随机、开放标签试验,478 名 ER+, HER2- 晚期或转移性乳癌受试者都曾接受过 1-2 线贺尔蒙治疗,包括 CDK4/6 抑制剂药物,478 人中约有 47.8% 检测出带有 ESR1 突变。受试者以 1:1 随机分派接受 elacestrant 400 mg 每日口服(n=239),或者单一的贺尔蒙标准治疗(standard-of-care, SOC)(n=238),包含 fulvestrant, letrozole, anastrozole, exemestane。
试验主要评估指标分别为整体受试者、带有 ESR1 突变次族群的疾病无恶化存活期(progression-free survival, PFS),两项皆达标。和标准治疗组相比,elacestrant 试验组的 ESR1 突变次族群的疾病恶化或死亡风险降低 45%,两者中位数 PFS 分别为 1.9 vs. 8.6 个月(SOC vs. elacestrant )。
目前 Stemline 同步进行将 elacestrant 与其他药物联用于乳癌试验,如合并 abemaciclib, onapristone 等。未来该公司也预计将 elacestrant 扩大用于早期乳癌的治疗评估。
参考资料:
1. https://www.prnewswire.com/news-releases/stemline-therapeutics-a-subsidiary-of-menarini-group-receives-us-fda-approval-for-orserdutm-elacestrant-as-the-first-and-only-treatment-specifically-indicated-for-patients-with-esr1-mutations-in-er-her2–advanced-or-metast-301733294.htm
2. Journal of Clinical Oncology (2022) https://pubmed.ncbi.nlm.nih.gov/35584336
©www.geneonline.news. All rights reserved. 基因线上版权所有 未经授权不得转载。合作请联系:service@geneonlineasia.com