基因疗法是用健康基因取代问题基因的一种现代医学技术,科学家们希望只需一剂注射来解决过去无法治疗的疾病,且数十年来,基因编辑工具的进步也让该领域突飞猛进,成为不少生技企业奋力角逐的新兴市场。
上一篇文章了解过基因疗法的缘起与起落后,接下来基因线上 GeneOnline 将解密基因疗法的不同载体特色与传递机制,让读者迅速理解基因疗法的面貌。
延伸阅读:纵览基因疗法演进:充满希望的序幕、挫败、如何再起基因疗法仅限于编辑体细胞
依照传递及作用标的的不同,基因疗法可分成生殖细胞(germ cell)基因疗法和体细胞(somatic cell)基因疗法。前者将基因输送至卵子、精子等生殖细胞;后者将基因传递至骨髓、血液、皮肤细胞等体细胞。目前,所有基因疗法皆针对体细胞,这是因为编辑生殖细胞的基因会连同改变下一代人的基因体,而基于伦理道德考量,所以尚未有针对生殖细胞的基因疗法出现。
另一方面,体细胞基因疗法有 3 类,一是将基因传递至患者血液的活体(in vivo)疗法,二是在实验室编辑患者细胞的基因,再输送回人体的体外(ex vivo)疗法,最后则是直接让基因进入目标器官或组织的原位(in situ)疗法。
病毒载体:转染效率高、可标靶特定细胞
基因疗法采用病毒载体与非病毒载体等 2 种方式进行基因转移(gene transfer)。
病毒载体是使用病毒入侵人体与扩散的特性进行基因转移,但必须先去除病毒的自我复制机制与致病性,降低患者致病风险,即可作为该疗法的载体使用;而病毒的转导效率就决定了基因转移的功效。
病毒载体有嵌入型载体(integrating vectors)与非嵌入型载体 2 种,前者如反转录病毒(retrovirus)、慢病毒(lentivirus)可以嵌入患者 DNA,后者如腺病毒(adenovirus)、腺相关病毒(adeno-associated virus, AAV)、疱疹单纯型病毒(herpes simplex virus, HSV)则会成为游离 DNA(episomal DNA),保留在细胞核中。
而这 2 种载体的差别在于,游离载体不会在患者 DNA 中自行复制,也就是说,载体在细胞分裂后不会存在于子细胞,可在短时间内消失,这对追求转殖基因短期表现的疗法十分有用。
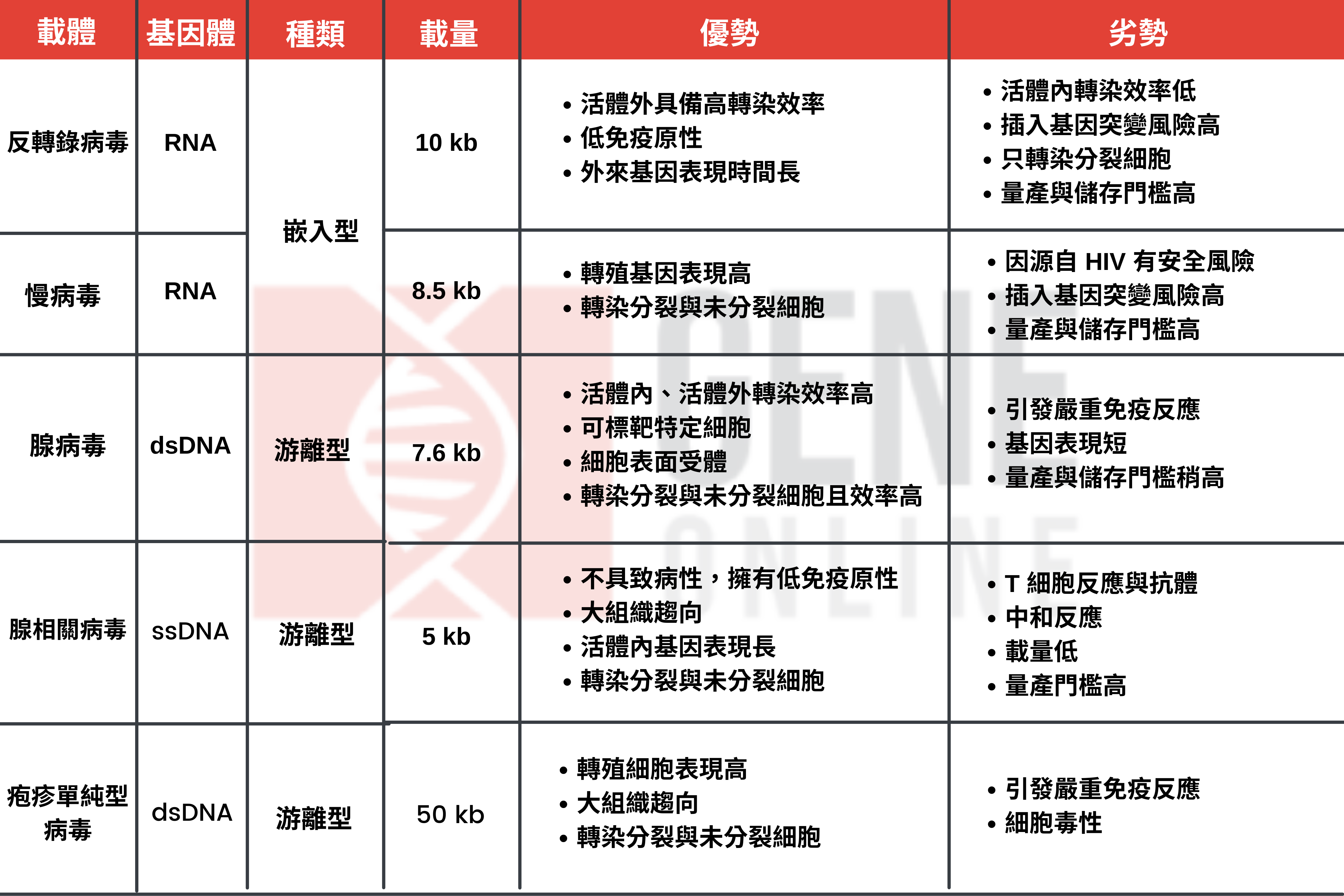
病毒载体中有 DNA 与 RNA 病毒之分。DNA 病毒载体已用于癌症、爱滋病、神经疾病、心血管疾病等多种临床候选药物中,举凡腺病毒、AAV、HSV;而像是慢病毒等 RNA 病毒载体则被用于暂时表现(transient expression)转殖基因,时下多用于爱滋病治疗的临床试验。
好用的病毒载体有哪些标准?
判定一个病毒载体是否优秀,可从载量、基因表现时效、组织趋向(能感染的细胞类型和数目)与转导效率来看。最重要的是,拥有低致病性与免疫原性,才不会在进入人体后引发严重的免疫反应。总体来说,AAV 病毒载体是目前主流的基因疗法传递方式。
美国 FDA 已核准 2 款 AAV 基因疗法,分别是 Novartis 治疗脊髓性肌肉萎缩症(spinal muscular atrophy)的 Zolgensma(AAV9)与 Spark Therapeutics 治疗莱伯氏先天性黑蒙症(leber congenital amaurosis)的 Luxturna(AAV2)。
此外还有多款 AAV 候选基因疗法正于第 2/3 期临床试验,譬如 Pfizer 治疗 A 型血友病的 SB-525(AAV6)、AskBio 治疗 B 型血友病的 AskBio 009(AAV8)、Takeda 治疗 A 型血友病的 TAK-754(AAV8)、Biogen 治疗脉络膜缺失症(choroideremia)的 timrepigene emparvovec(AAV2)、Homology Medicines 治疗苯丙酮尿症(phenylketonuria)的 HMI-102(AAVHSC15)等。
非病毒载体:安全性高、量产门槛低、便宜
制造非病毒载体以裸露质体 DNA(naked plasmid DNA)与微脂体(liposome)为大宗。它们因拥有低免疫原性,比病毒载体更安全,价格上也因量产门槛低,所以更便宜。然而非病毒载体的转染效率(transfection efficiency)并不高,且难以标靶特定细胞种类,同时也需大数量的载体才有办法达到治疗功效。
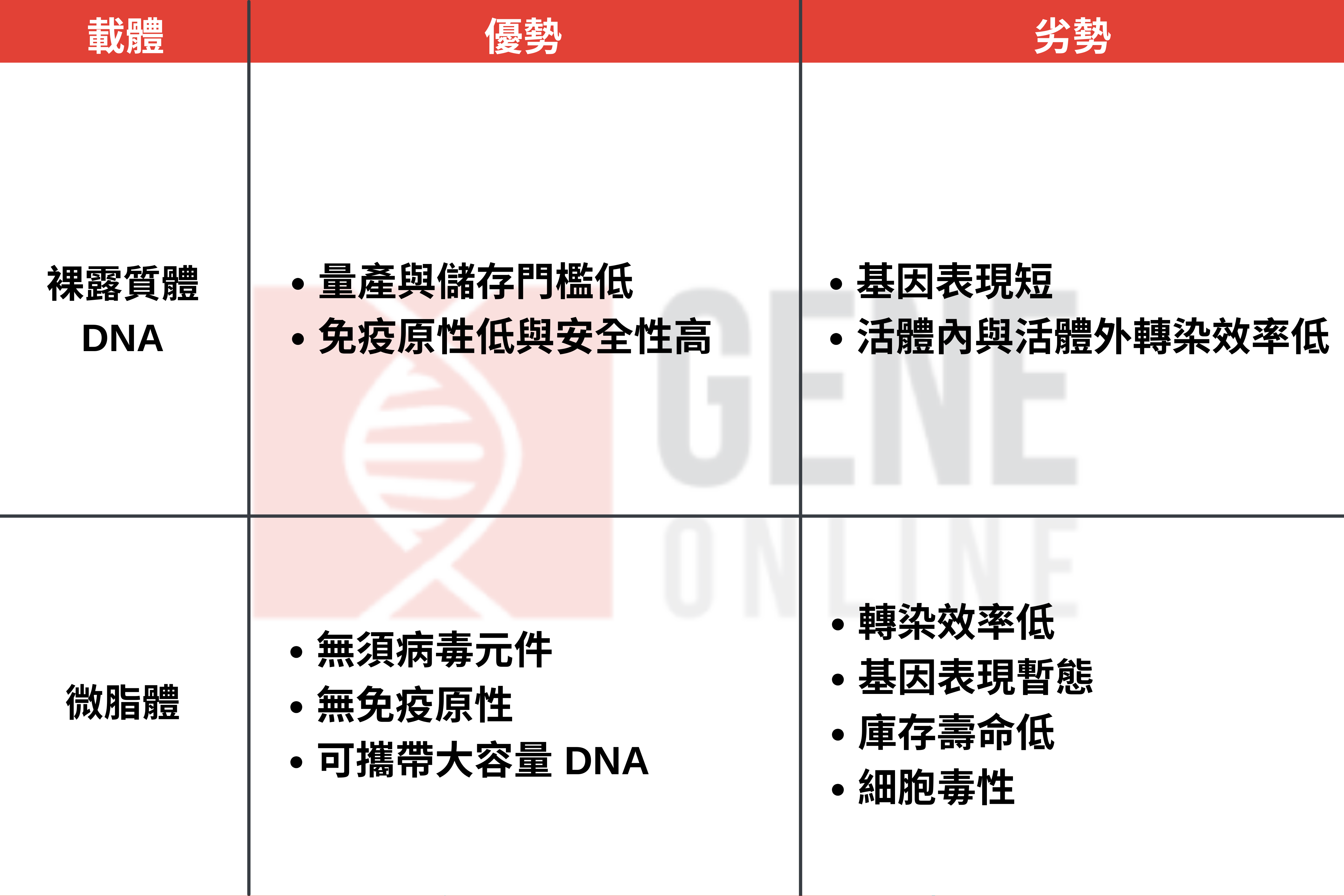
非病毒载体的基因传递机制
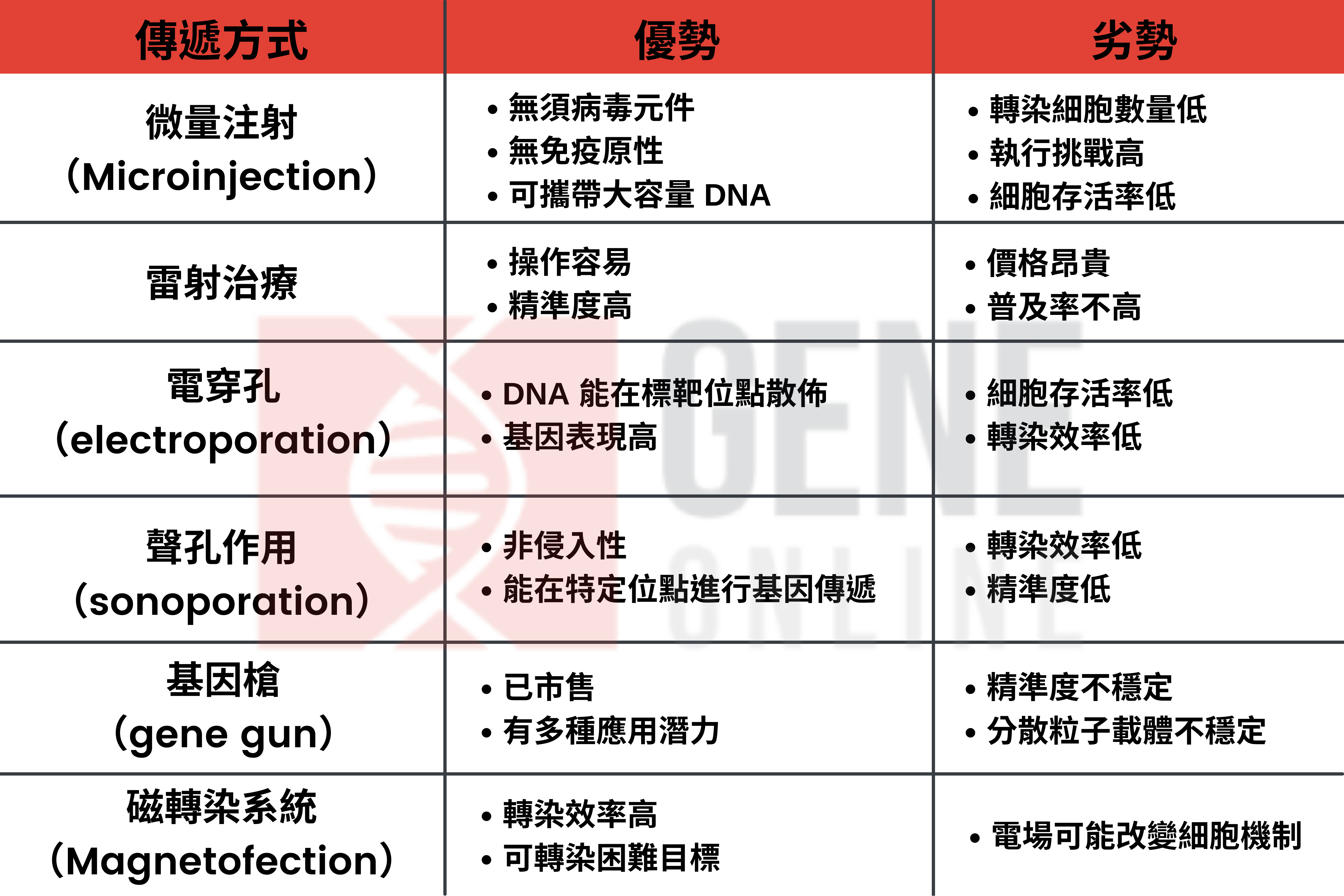
非病毒载体拥有多种传递方式。首先是微量注射(microinjection),这常用于制作基因转殖小鼠上,但因为质体在核酸内切酶血清(serum endonucleases)中会迅速降解,也容易受胞内体陷套(endosomal entrapment)与肾脏清除作用(renal clearance)破坏,所以微量注射并非传递质体 DNA 的最佳方式。
二来是雷射治疗、电穿孔(electroporation)与声孔作用(sonoporation),利用辐射、电场和高密度超声波,来增加标靶细胞的渗透性与摄取。第三是使用重金属传递裸露 DNA 的基因枪(gene gun),最后是使用电场能量传递 DNA 奈米粒子的磁转染系统(Magnetofection)。
基因编辑工具 CRISPR、ZFN、TALEN 的时代
基因编辑工具 ZFN、TALEN 与 CRISPR/Cas 的出现大幅增加了基因疗法的治疗范围,也让人类可直接编辑人体的基因缺陷。
相较传统基因疗法,CRISPR 不仅治疗成本低、精准度高,也拥有相对低的执行门槛,主要由 AAV 载体传递。研究人员可把 Cas9 酶和导引 RNA 放入 DNA 质体载体,再装入 AAV 即可使用;但 AAV 载体由于载量较低,所以仍有技术挑战要解决。
CRISPR 基因疗法还可将导引 RNA 放入能表现 Cas9 的细胞中进行传递,另外也有将 Cas9 的 N- 端与 C- 端放入 2 个 AAV 载体,并在转染细胞时组合成可正常运作的 Cas9 进行治疗。目前 CRISPR 基因疗法的最新传递方式是使用金黄色葡萄球菌(Staphylococcus aureus)的小型 Cas9,这种方式较不占据 AAV 载体的空间。
CRISPR 常用于活体外基因疗法,举凡 CRISPR Therapeutics 与 Vertex Pharmaceuticals 透过编辑造血干细胞,共同开发的 β-地中海型贫血症与镰刀型红血球疾病(SCD)的 CRISPR 基因疗法 CTX001。
另一方面,CRISPR 在治疗杜氏肌肉萎缩症(Duchenne muscular dystrophy, DMD)与遗传性高酪胺酸血症(hereditary tyrosinemia)上会采用静脉或针对特定组织注射的活体内治疗方式,例如史上第 1 个直接注射于人体的基因疗法,由 Editas Medicine 开发治疗莱伯氏先天性黑蒙症的 EDIT-101 就是一例。
基因疗法前景可期
尽管基因疗法在制造、安全性、功效上仍有挑战,但仍是遗传性单基因疾病与复杂重症的潜力解方。而时下全球基因疗法领域中,可见源源不绝的创新与资本投入,这些将成为基因疗法技术突破与克服应用挑战的良好基础,更有望在未来造福更多患者。
作者:Rajaneesh K. Gopinath
编译:Tyler

参考资料:
1. https://geneonline.news/en/a-brief-sketch-of-gene-therapy-vectors-and-delivery-methods/
©www.geneonline.news. All rights reserved. 基因线上版权所有 未经授权不得转载。合作请联系:service@geneonlineasia.com





