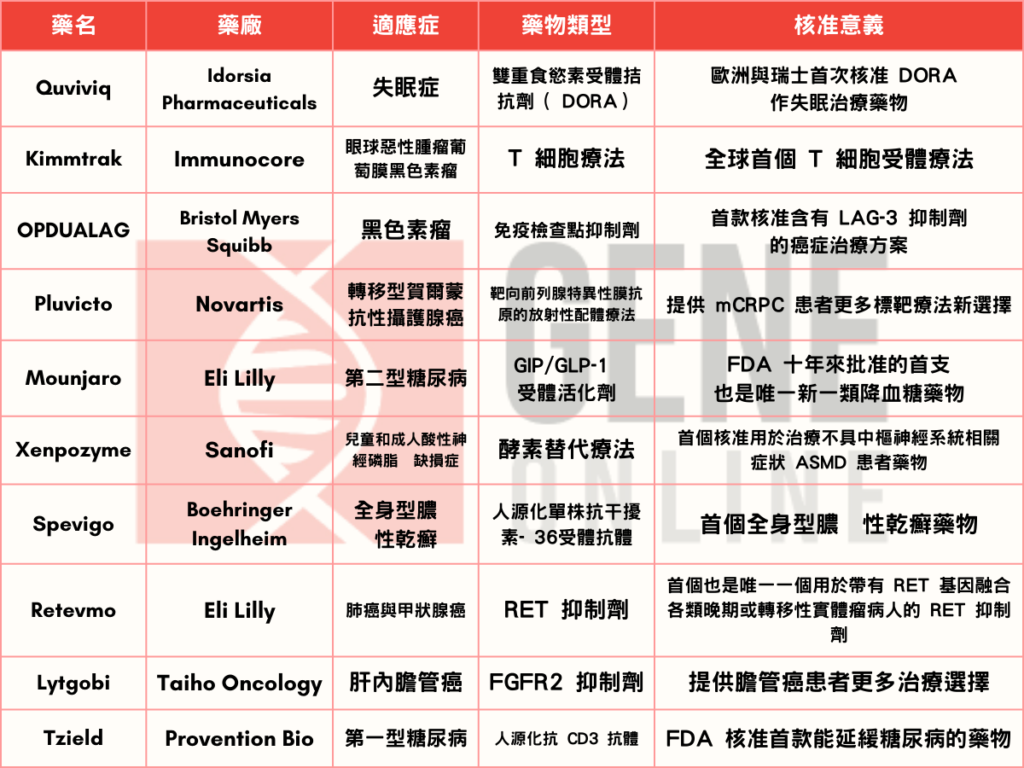
美國食品藥物管理局(FDA)的藥品評估暨研究中心(Center for Drug Evaluation and Research, CDER)每年都會批准各領域的新藥或是生物製劑,這些產品中的成分,都是 FDA先前未核准使用,同時也是對該領域患者族群相當重要的新療法。2022 年獲批的藥物與生物製劑領域包含癌症、糖尿病、血液疾病、自體免疫、感染、罕見疾病,以下由基因線上挑選 10 項不同領域的藥品與生物製劑,回顧關鍵臨床數據與重要作用機制(mechanism of action,MOA),透過觀察 2022 新藥核准項目,希望能幫助讀者們展望規劃 2023 發展方向。
1. 不用再數羊 ! 失眠新藥 Quviviq
FDA 在今年一月份核可 Quviviq 作為改善失眠用藥,Quviviq 在美國獲批之後,緊接著 4 月在歐洲、12 月在瑞士也獲批上市許可,這是歐洲與瑞士第一個核准的 DORA 作為失眠治療藥物,日本亦有三期試驗進行中,相信其他國家在未來也很可能跟進使用。
Quviviq 是一種雙重食慾素受體拮抗劑(Dual Orexin Receptor Antagonist, DORA),可與兩種食慾素受體 OX1/OX2 結合,進而阻斷食慾素與其 GPCR(G protein-coupled receptor)受體交互作用,食慾素受體主要分布在大腦清醒與情緒區域,Quviviq 阻斷作用可達到抑制清醒與治療失眠的效果。其他值得注意的副作用,本身若有心理失調的患者,使用 Quviviq 可能加重憂鬱症狀與增加自殺的風險。交互作用方面,需注意當與 CYP3A4 抑制劑或有抑制成分的食物一起服用時,會增加血液中 Quviviq 濃度。
2. 美國 FDA 批准第一個 T 細胞受體療法 Kimmtrak
美國 FDA 在 2022 年批准第一個 T 細胞受體 (T cell receptor, TCR) 療法— Kimmtrak,專門用於無法切除或是轉移性的成人眼球惡性腫瘤—葡萄膜黑色素瘤(uveal melanoma)。 Kimmtrak 的 T 細胞受體端會結合癌細胞表面的 gp100-HLA-A*02:01 ,另一端 anti-CD3 scFv 會結合並活化帶有 CD3 的 T 細胞,連結活化 T 細胞與黑色素瘤細胞達到消滅癌細胞作用。
細胞激素釋放症候群(Cytokine Release Syndrome,CRS)發生機率超過 30%,必須視 CRS 持續症狀調整用藥方式。免疫檢查點抑制劑 pembrolizumab(anti-PD-1)或 pilimumab(CTLA-4)是轉移性黑色素瘤的標準照顧治療方法,因此 Kimmtrak 勢必要與現行療法比較效果與安全性,根據發表在 NEJM 的臨床三期結果,一年的整體生存率在 Kimmtrak 組為 73%,控制組(使用免疫藥物或化學治療)為 59% ,第三與第四級的副作用事件發生率在 Kimmtrak 組為 44% ,對比控制組為 17% 。
3. OPDUALAG ,一加一大於二 ,雙免疫檢查點抑制劑時代正式來臨
獲得 FDA 批準的 OPDUALAG 療法,是 Nivonumab (anti-PD-1) 與 Relatimab (anti-LAG-3) 聯用,治療 12 歲以上兒童與成人的無法切除或轉移性黑色素瘤。
由於在試驗中聯用的效果顯著優於 Nivonumab 單用(中位數無進展生存期為10.1 vs. 4.6個月), LAG-3 抗體終於突破單獨使用效果不佳的困境,因此 Relatimab 也算是美國 FDA 第一個核准使用的 LAG-3 抗體, LAG-3 受體負責抑制活化的 T 細胞,其中也包括關鍵的腫瘤浸潤型T細胞,透過降低細胞激素 IL-2 減少 T 細胞數量並減少對付腫瘤細胞激素例如 TNF-α 、 IFN-γ ,參與腫瘤細胞逃逸免疫機制,伴隨 OPDUALAG 獲批,日後與 LAG-3 相關的治療產品或檢驗試劑也將增加,雙免疫檢查點抑制劑也仍是未來值得關注的癌症治療方向。
4. Pluvicto —鎦 177-PSMA 骨轉移攝護腺癌的治療新選擇
由 Novartis 開發的 Pluvicto , FDA 在今年3月核准使用於轉移型賀爾蒙抗性攝護腺癌 (metastasis castration-resistant prostate cancer, mCRPC) 。 Pluvicto 是靶向前列腺特異性膜抗原 (Prostate Specific Membrane Antigen, PSMA) 的放射性配體療法 (Radio ligand Therapy, RLT), Pluvicto1L 包含 PSMA 抑制劑 Vipivotide tetraxetan 與具有 β 放射線的鎦 177 (Lutetium, 177 lu) ,當 Vipivotide tetraxetan 與癌細胞結合則可對其造成放射線殺傷。
臨床三期中, Pluvicto 可以顯著提高整體生存期,並降低 38% 死亡風險。此項批准同時還包括 Pluvicto 的伴隨診斷試劑 Locametz , Locametz 是 gallium 68Ga gozetotide ,用於正子攝影 PET ,標記身體各處可能有 PSMA 表達的攝護腺癌細胞。其他類似藥物例如 Actinium-225-PSMA 等也已在三期臨床試驗,由於 Pluvicto 的成效與較小副作用,亦有試驗開展用於早期轉移攝護腺癌患者,基因線上將持續關注最新發展。
5. 瘦瘦筆再升級— Mounjaro
FDA 在今年五月批准禮來 (Eli Lilly) 的 Mounjaro(trizepatide)注射液,用於改善第二型糖尿病患者的血糖控制,作為節食與運動的輔助。
現有筆型GLP-1注射器(又名瘦瘦筆)之中,成分大致為 liraglutide 或 semaglutide ,皆為 GLP-1 類似物,可以促進 β 細胞生長增加胰島素分泌,並且有抑制食慾作用, Mounjaro 的成分 trizepatide 同時為 GLP-1 和 glucose-dependent insulinotropic polypeptide (GIP) 的促效劑 (agonist) 。
在為期 40 週的 SURPASS-2 臨床試驗中,三種劑量的 trizepatide 比 semaglutide 都能顯著降低更多糖化血色素百分比(Glycohemoglobin, HbA1c),體重減少方面也有相同趨勢,使用最高劑量的 trizepatide 的患者比 semaglutide 平均減少 5.5 公斤,但是由於在大鼠中觀察到 Mounjaro 會導致甲狀腺C細胞腫瘤,雖然目前不清楚在人體中是否也有同樣效應,但是甲狀腺髓質癌或多發性內分泌腫瘤患者不應使用。
6. 罕見疾病—酸性神經磷脂酶缺損症 救命藥 Xenopozime
FDA 於八月份核准賽諾菲 (Sanofi) 的 Xenpozyme (Olipudase alfa) ,用於兒童和成人酸性神經磷脂酶缺損症(Acid Sphingomyelinase Deficiency, ASMD)。
在美國有超過 7000 種罕見疾病,罕病人數約 3000 萬人,換算大約十人中即有一人罹患罕見疾病。ASMD 是一種無法活過兩到三歲,即使成年也會由於呼吸衰竭而早逝的罕見基因遺傳疾病, Xenpozyme 是第一個核准用於治療不具中樞神經系統相關徵狀 ASMD 患者藥物。由於缺乏 Acid Sphingomyelinase 分解鞘磷脂(Sphingomyelin),鞘磷脂累積在肝、脾、肺和腦中產生病灶, Xenpozyme 以補充酵素的方法,代謝鞘磷脂達到緩解症狀目的,臨床試驗數據顯示, Xenpozyme 可有效改善患者肺功能,並減少成人與兒童肝和脾臟體積,但由於 Xenpozyme 無法通過血腦屏障,因此無法調控累積於腦部的鞘磷脂。
7. 全身型膿疱性乾癬患者福音— Spevigo
今年九月,百靈佳殷格翰(Boehringer Ingelheim)研發的 Spevigo 獲得 FDA 許可,其適應症為全身型膿疱性乾癬 (Generalized Pustular Psoriasis, GPP) 。
Spevigo 的成分為 Spesolimab ,是人源化單株抗干擾素- 36受體抗體(humanized anti–interleukin-36 receptor monoclonal antibody), GPP 屬於自體免疫的罕見皮膚炎疾病,由於患者 IL36RN 與相關基因發生失去功能的突變(Loss of function),導致其 IL-36 過度產生而形成皮膚病灶。在 Spevigo 出現之前,現行療法依照輕重度進行局部外用或全身性類固醇藥物緩解,雖然在亞洲國家也有生物製劑 TNF-α 、 IL-17 、 IL-23 抗體於臨床試驗中使用,但都不是直接針對 IL-36 , Spevigo 是美國 FDA 核准首款 GPP 藥物,可以直接阻斷 IL-36 與其受體結合,達到緩解效果。
8. 多種晚期癌症適用藥物— Retevmo
時光回到 2020 年,禮來的 Retevmo 獲得 FDA 批准使用具有 RET 基因突變或融合條件的肺癌與甲狀腺癌,今年九月 FDA 同意加速核准 Retevmo 用於成人帶有重組 RET 基因融合情形之晚期原位侵犯性或轉移性實體腫瘤,在 LIBRETTO-001 試驗中 RET 基因融合陽性(RET fusion-positive)腫瘤受試者,包括胰腺、大腸、卵巢、乳癌等癌症,總反應率(Overall response rate, ORR)為 44% 與反應時間(Duration of response)為 24.5 個月。
由於癌細胞分裂速度快,複製時常產生染色體錯置,使一些特定基因與 RET 基因融合,導致畸形受體不需配體即可持續二聚化發送生長訊號,因此這類靶向 RTK 的藥物可適用於 RTK 高度表達的各類癌症中,抑制變異的 RET 阻止細胞持續分裂與抑制腫瘤生長。
9. 生存期小於三年的肝內膽管癌患者的一線希望 – Lytgobi
FDA 於九月底批准 Taiho Oncology 公司的 Lytgobi(futibatinib),使用於治療肝內膽管癌 (intrahepatic cholaniocarcinoma, ICC),適用條件包括先前已接受過治療、無法切除、局部侵犯性或轉移的肝內膽管癌,並帶有表達融合重組的第二型纖維母細胞生長因子受體(Fibroblast Growth Factor Receptor 2, FGFR2)基因。
肝內膽管癌屬於肝臟內發生的癌症,只有少數約15%的患者可以手術,中位數生存期為 27-36 個月,約 10-16% 的患者其腫瘤細胞有 FGFR2 基因重組融合情形。 Lytgobi為FGFR2 抑制劑,可以阻斷訊號傳遞停止細胞生長, Lytgobi 先前已獲得 FDA 突破性療法、孤兒藥與優先審批的資格,在 103 名受試者的二期試驗中,客觀反應率(Objective response rate, ORR)為 42% ,中位數持續反應時間為 9.7 個月, 72% 的患者可以持續反應 6 個月。
10. 用免疫治療延遲第一型糖尿病進程— Tzield
FDA 核可由 Provention Bio 研發的 Tzield(teplizumab-mzwv)作為第一型糖尿病第二期用藥,可減慢進入第三期的時間, Tzield 是人源化抗 CD3 抗體,且不與 Fc 受體結合(Fc receptor non-binding humanized monoclonal anti-CD3),以調節免疫系統的方式延緩第一型糖尿病至三期的進程,獲得正式許可算是在第一型糖尿病治療方法上跨出一大步。
在 76 位患者的試驗中,試驗組每日注射Tzield或安慰劑持續 14 天,療效的主要指標是到診斷由 2期轉為 3 期 1 型糖尿病的時間,接受 Tzield 治療的 44 名患者中有 45% 後來被診斷為 3 期 1型糖尿病,而接受安慰劑治療的 32 名患者中有 72% ,進展到 3 期 1 型糖尿病的時間, Tzield 組為 50 個月,安慰劑組為 25 個月,顯著延遲第一型糖尿病進展。
©www.geneonline.news. All rights reserved. 基因線上版權所有 未經授權不得轉載。合作請聯繫:service@geneonlineasia.com






